
 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
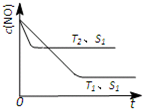 ��2013?����һģ����������β���Ǽ��ٳ��п�����Ⱦ���ȵ��о����⣮
��2013?����һģ����������β���Ǽ��ٳ��п�����Ⱦ���ȵ��о����⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1 mol Cl2�����л�ѧ������ʱ��Ҫ����243kJ������
����Hԭ�Ӻ�Clԭ���γ�1 mol HCl����ʱ�ͷ�431kJ������
����������ȷ����
A.������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��H2(g)+Cl2(g)��2HCl(g)
B.������������Ӧ����2 mol�Ȼ������壬��Ӧ�ġ�H��183kJ/mol
C.������������Ӧ����2 mol�Ȼ������壬��Ӧ�ġ�H����183kJ/mol
D.������������Ӧ����1 mol�Ȼ������壬��Ӧ�ġ�H����183kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����1 mol H2�����л�ѧ������ʱ��Ҫ����436 kJ������
��1 mol Cl2�����л�ѧ������ʱ��Ҫ����243 kJ������
����H��Cl�γ�1 mol HCl����ʱ�ͷ�431 kJ������
����������ȷ���ǣ� ��
A.������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��H2(g)+Cl2(g)====2HCl(g)
B.������������Ӧ����2 mol�Ȼ������壬��Ӧ�Ħ�H=+183 kJ��mol-1
C.������������Ӧ����2 mol�Ȼ������壬��Ӧ�Ħ�H=-183 kJ��mol-1
D.������������Ӧ����1 mol�Ȼ������壬��Ӧ�Ħ�H=-183 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ��̩�и�����ѧ�ڽλ�ѧ�Ծ��������棩 ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
|
�� �ȣ��棩 |
360 |
440 |
520 |
|
Kֵ |
0��036 |
0��010 |
0��0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ���ȷ�Ӧ�������� ��
�� �����ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��������ţ�
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����Ӧ CH4(g)
+ H2O (g) CO(g)
+ 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g)
+ 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�  �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��

��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1 P2���>������=����<������
�ڸ÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3��ԭ����H2����ͨ����ӦCO(g) +
H2O(g) CO2
(g) + H2(g) ��ȡ��
CO2
(g) + H2(g) ��ȡ��
��T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0��08 mol��L-1����ƽ��ʱCO��ת����Ϊ �����¶��·�Ӧ��ƽ�ⳣ��KֵΪ ��
�ڱ����¶���ΪT �棬�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬���� ������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n (CO) : n (H2O) : n (CO2) : n (H2)��1 : 16 : 6 : 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���㽭ʡ�����ڶ����¿���ѧ�Ծ��������棩 ���ͣ�������
��10�֣���1����CH4����ԭNOx�������������������Ⱦ�����磺
CH4(g)+4NO2(g)��4NO(g)��CO2(g)+2H2O(g)�����ȣ���574 kJ��mol-1
CH4(g)+4NO(g)��2N2(g)��CO2(g)+2H2O(g)�����ȣ���1160 kJ��mol-1
���ñ�״����4.48��CH4��ԭNO2��N2������������ת�Ƶĵ�������Ϊ���� ����������٤��������NA��ʾ�����ų�������Ϊ���������� kJ��
��2����֪��C3H8(g ) ==== CH4(g)��HC��CH(g)��H2(g) ��H1��156.6kJ��mol-1
CH3CH��CH2(g) ==== CH4(g)��HC��CH(g) ��H2��32.4kJ��mol-1
����ͬ�����£���ӦC3H8(g)====CH3CH��CH2 (g)��H2(g)�ġ�H�� kJ��mol-1��
(3)�����ڸ�������ˮ������Ӧ��Ӧ����ʽΪ��CH4(g)��H2O(g)��CO(g)��3H2(g)���������ʵ�ȼ�����������ұ��� ��֪1mol H2O(g)ת��Ϊ1mol H2O(l)ʱ�ų�44.0 kJ������д��CH4��H2O�ڸ����·�Ӧ���Ȼ�ѧ����ʽ ��
|
�� �� |
ȼ���ȣ�kJ��mol��1�� |
|
H2(g) |
��285.8 |
|
CO(g) |
��283.0 |
|
CH4(g) |
��890.3 |
(4)��������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ��ȡ����ȼ�ϵ�ء���д���õ�ص�������Ӧʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com