
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
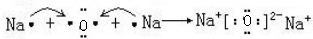 .
. 分析 A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;B为氧元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为铝元素;E与C同周期,其原子半径在该周期最小,则E为氯元素,据此进行解答.
解答 解:A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为氢元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为氧元素;B为氧元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为铝元素;E与C同周期,其原子半径在该周期最小,则E为氯元素,
(1)由分析可知,C为钠元素;E为氯元素,故答案为:钠;氯;
(2)B、C、D的简单离子分别为O2-、Mg2+、Al3+,核外电子层结构相同,核电荷数越大离子半径越小,所以离子半径大小为:O2->Mg2+>Al3+,
故答案为:O2->Mg2+>Al3+;
(3)A、B、C分别为H、O、Na,组成的化合物M为NaOH,
①E的单质为氯气,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②D的单质为金属铝,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)C2B为Na2O,Na2O为离子化合物,用电子式表示Na2O的形成过程为: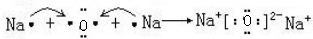 ,
,
故答案为: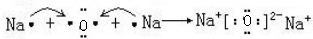 .
.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题知识点较多,充分考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3-CH3 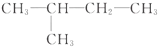 | B. | CH2═CH-CH3,CH2═CH-CH2-CH3 | ||
| C. | CH3-CH2-OH,CH3-CH2-CH2-CH3 | D. | 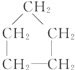 , ,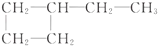 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
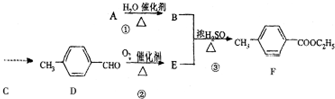
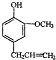 )是一种重要的调味剂,它与F的关系是b.
)是一种重要的调味剂,它与F的关系是b.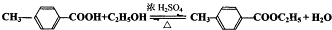 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
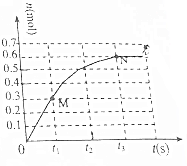 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com