
 在不同温度下,反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
在不同温度下,反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| n(CO)?n(H2O) |
| n(CO2)?n(H2) |
 ,
,
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| n(CO)?n(H2O) |
| n(CO2)?n(H2) |
| 1×5 |
| 2×3 |
| 5 |
| 6 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| n(CO)?n(H2O) |
| n(CO2)?n(H2) |
| 2×2 |
| 1×1 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| n(CO)?n(H2O) |
| n(CO2)?n(H2) |
| 2×0.5 |
| 1×1 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| n(CO)?n(H2O) |
| n(CO2)?n(H2) |
| 3×1 |
| 2×1 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| x2 |
| (2-x)2 |


科目:高中化学 来源: 题型:
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类不相同 |
| C、均存在c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、均存在c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L Na2CO3溶液:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) |
| B、能使紫色石蕊试液呈红色的溶液:Na+、NH4+、I-、NO3-可以大量共存 |
| C、任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
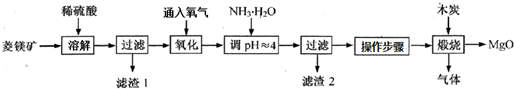
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
| 800℃ |
| 800℃ |
| 800℃ |
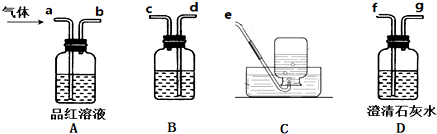
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
| C、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O |
| D、向水杨酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com