
 工业上合成合成氨的热化学方程式如下:
工业上合成合成氨的热化学方程式如下: ,故答案为:
,故答案为: ;
;| △c |
| △t |
| ||
| 2min |
 ,故答案为:向右;不变;
,故答案为:向右;不变; .
.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O═2NaOH |
| B、SO2+H2O═H2SO3 |
| C、Cl2+H2O═HCl+HClO |
| D、4Li+O2═2Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率增大 |
| D、C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | V | W | X | Y | Z |
| 原子半径(×0.1nm) | 0.37 | 0.77 | 0.75 | 0.74 | 1.85 |
| 电负性 | 2.1 | 2.5 | 3.0 | 3.5 | 1.66 |
| 常见化合价 | +1 | +4,-4 | +5,+3,-3 | -2 | +6,+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、③两种溶液等体积混合后,pH可能不等于7 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
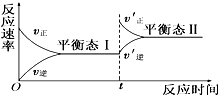 如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )| A、平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B、平衡移动的原因可能是增大了反应物浓度 |
| C、平衡移动的原因可能是增大了压强 |
| D、平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液加入硫酸酸化的氯化钡溶液,以检验SO42-的存在 |
| B、向某溶液中滴加浓氨水,以检验Al3+的存在 |
| C、用铂丝蘸取某溶液在火焰上灼烧,直接观察火焰颜色,以检验K+的存在 |
| D、向某溶液中加入稀硝酸酸化的硝酸银溶液,以检验Cl-的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、棕红色Br2蒸气加压后颜色变深 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com