
| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
分析 二氧化氮为红棕色气体,密度比空气密度大,二氧化氮能够与水反应生成一氧化氮和硝酸,二氧化氮是形成酸雨的主要成分之一,以此解答该题.
解答 解:A.二氧化氮中N元素化合价为+5价,硝酸中N元素化合价为+5价,化合价不相等,则二氧化氮不是硝酸的酸酐,故A正确;
B.二氧化氮和水反应合成NO和硝酸,N元素化合价发生变化,发生氧化还原反应,故B正确;
C.二氧化氮是形成酸雨的主要成分之一,且可形成光化学污染,故C错误;
D.二氧化氮可生成四氧化二氮,为可逆反应,则在通常状况下测得的NO2的相对分子质量是不准确的,故D正确.
故选C.
点评 本题考查了二氧化氮的物理性质、化学性质,题目难度不大,注意掌握氮的氧化物性质及对环境的影响,明确二氧化氮为红棕色气体、一氧化氮为无色气体.


科目:高中化学 来源: 题型:选择题
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
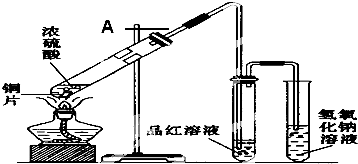
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
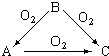 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
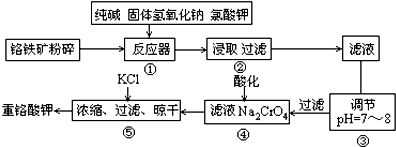
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (对苯醌)═N2H4+
(对苯醌)═N2H4+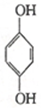 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为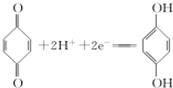 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com