
(12分)某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
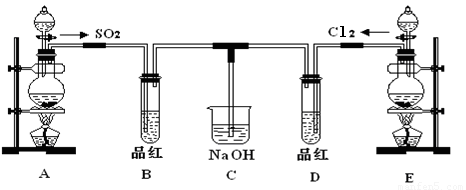
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)________________
(3)实验结束后,有同学认为装置C中会含有Na2SO4,如何验证Na2SO4是否存在?
(1)①B:品红溶液褪色,D:品红溶液褪色。
②B:褪色的品红又恢复为红色,D:无明显现象。
(2)Cl2+SO2+2H2O=2HCl+H2SO4
(3)取C中溶液先加盐酸,再加氯化钡有白色沉淀生成,证明有硫酸钠。
【解析】(1)①SO2具有漂泊性,能使品红溶液褪色。氯气溶于水产生的次氯酸也具有漂泊性,也能使品红溶液褪色。
②用于SO2的漂白是不稳定的,所以加热后又恢复原来颜色。而次氯酸的漂白是氧化导致的,不可逆的,所以不能恢复原来颜色。
(2)SO2具有还原性,而氯气具有氧化性,二者发生氧化还原反应,方程式为Cl2+SO2+2H2O=2HCl+H2SO4,从而失去漂泊性。
(3)检验硫酸盐一般用盐酸和氯化钡溶液,即取C中溶液先加盐酸,再加氯化钡有白色沉淀生成,证明有硫酸钠。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
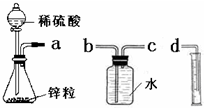 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸 | 10mL | t1 | v1 |
| 4mol/L硫酸 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com