
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
分析 由表格中数据可知,X、Y的浓度减少,为反应物,而Z的浓度增加为生成物,△c(X):△c(Y):△c(Z)=0.05mol/L:0.15mol/L:0.1mol/L=1:3:2,则反应为X+3Y?2Z,结合K与温度有关,与压强无关来解答.
解答 解:A.反应达到平衡时,X的转化率为$\frac{0.1-0.05}{0.1}$×100%=50%,故A正确;
B.由速率之比等于化学计量数之比,相同时间内浓度变化量之比等于速率之比,则反应为X+3Y?2Z,故B正确;
C.K与温度有关,反应中一定有能量变化,则改变温度可以改变此反应的平衡常数,故C正确;
D.该反应为气体体积减小的反应,则增大压强使平衡向生成Z的方向移动,但平衡常数不变,故D错误;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、反应的确定、转化率的计算为解答的关键,侧重分析与计算能力的考查,注意K与温度有关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 化合反应 | C. | 离子反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
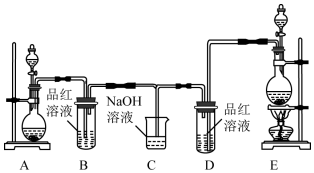
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
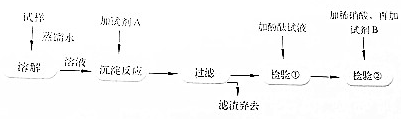
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
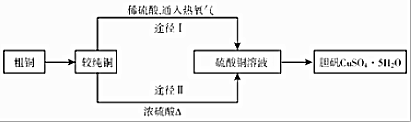
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、H+和H2是氢元素的四种不同粒子 | |
| B. | ${\;}_{20}^{40}$Ca和${\;}_{20}^{42}$Ca、石墨和金刚石均互为同素异形体 | |
| C. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:选择题
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.整个过程发生了复分解反应和氧化还原反应
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com