
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
【解析】(I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
【答案】(1)A NH3·H2O或NH3 ;E H2SO4 F AgNO3 C BaCl2
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验或反应中,最后固体质量增加的是( )
A.铜丝在空气中灼烧后迅速伸入乙醇蒸气中
B.铁粉与硫粉物质的量之比为1:1时混合加热
C.锌粉加入到氯化铜溶液中
D.去除氧化膜的铝条插入到浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
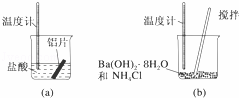
(1)某同学做如下实验,以检验反应中的能量变化.
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该 其生成物的总能量.
(2)下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):
能设计成原电池的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
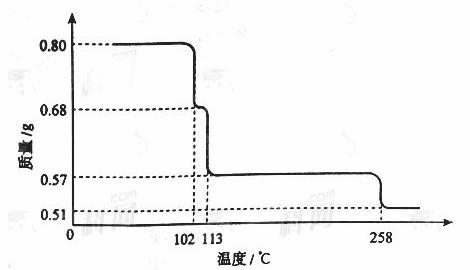
0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________m ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
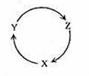
下列各组物质中,满足下图物质一步转化关系的选项是
|
| X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验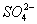 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验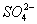 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
科目:高中化学 来源: 题型:
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:
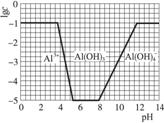
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
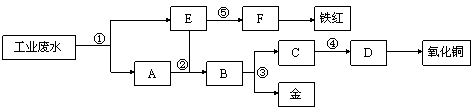
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤  ;
;
(2)写出①处发生反应的离子方程式 ;写 出③处发生反应的化学方程式 ;
出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,Na+物质的量浓度最大的是( )
|
| A. | 2L 0.5mol/L NaCl溶液 | B. | 3L 0.3mol/L Na2SO4溶液 |
|
| C. | 1L 0.4mol/L Na2CO3溶液 | D. | 4L 0.15mol/L Na3PO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com