
| A. | SO3 | B. | NaCl | C. | O2 | D. | 稀硫酸 |
分析 电解质是溶于水溶液中或在熔融状态下就能够导电(自身电离成阳离子与阴离子)的化合物,例如酸、碱和盐等;凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等.
解答 解:A、三氧化硫和水反应生成硫酸,硫酸能电离出自由移动的阴阳离子,所以三氧化硫的水溶液导电,但电离出离子的物质是硫酸不是三氧化硫,所以三氧化硫是非电解质,故A错误;
B、NaCl在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以NaCl是电解质,故B正确;
C、氧气属于单质,既不属于电解质又不属于非电解质,故C错误;
D、稀硫酸是混合物,既不属于电解质又不属于非电解质,故D错误;
故选B.
点评 本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将饱和的FeCl3溶液滴入沸水中形成Fe(OH)3胶体 | |
| B. | 蛋白质溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都不在1~100 nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
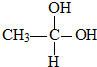 →CH3-CHO+H2O
→CH3-CHO+H2O
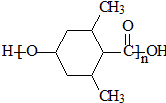 ]
]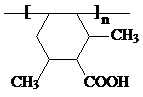 ;
;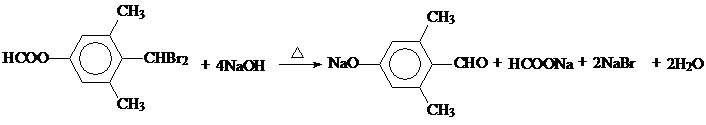 ;
; ;
;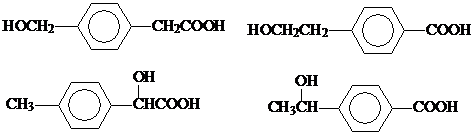 (任写一个).
(任写一个).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
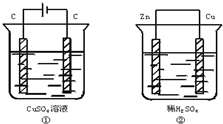 如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是( )| A. | 产生气体的体积:①>② | |
| B. | 电极总质量的变化:①增加,②减小 | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①装置中的阳极:4OH--4e-→2H2O+O2↑ ②装置中的负极:2H++2e-→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰、硫、熟石灰 | B. | 液态氧、胆矾、Fe(OH)3胶体 | ||
| C. | 铁、浓硫酸、氯化氮 | D. | 氮气、碘酒、碱式碳酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对应的最简单氢化物的热稳定性:Z>Y | |
| B. | X、Z、W三种元素形成的化合物既含离子键,又含共价键 | |
| C. | 元素X与Y形成的化合物中,每个原子都达到了8电子稳定结构 | |
| D. | X与Z可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com