


科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(H+)+c(A-)=0.1mol/L |
| C、溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D、与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| B、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| C、MgCO3可以除去MgCl2酸性溶液中的Fe3+ |
| D、在pH=1的溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
- 3 |
2- 3 |
- 3 |
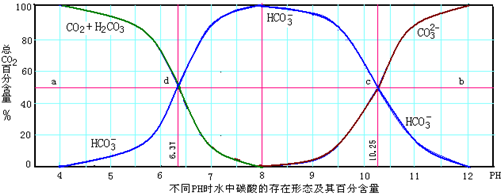
- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+;△H>0
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+;△H>0| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(mL) | 19.40 | 15.10 | 14.90 | 15.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,将两烧杯用导线相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
如图,将两烧杯用导线相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )| A、Cu极附近OH-浓度增大 |
| B、Cu极为原电池负极 |
| C、电子流向是由C极流向Pt极 |
| D、当C极上有4mol电子转移时,Pt极上有1mol O2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com