
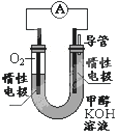
 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.分析 (1)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式,通过热化学方程式的意义得到放出的热量;
(2)①CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗;
②在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O;
(3)根据转移电子相等计算该元素的化合价、消耗甲醇的质量.
解答 解:(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
根据盖斯定律,将已知反应$\frac{1}{2}$×(①-②+③×4)得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=$\frac{1}{2}$×[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]=-442.8kJ•mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1,因此1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为442.8kJ,
故答案为:442.8kJ;
(2)①CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗,所以溶液的pH减小,
故答案为:减小;
②在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)设金属的化合价为x,则根据得失电子守恒关系可得$\frac{3360×1{0}^{-3}L}{22.4L•moL{\;}^{-1}}$×4=$\frac{10.4g}{52.00g•mol{\;}^{-1}}$×x,解得x=3,
n(O2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,得到0.15mol×4=0.6mol电子,由CH3OH+8OH--6e-=CO32-+6H2O可知,0.1mol甲醇失去0.6mol电子,因此甲醇的质量为0.1mol×32g/mol=3.2g,
故答案为:+3;3.2.
点评 本题考查较为综合,涉及反应热的计算、原电池原理,明确盖斯定律、电极反应式转移电子守恒即可解答,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
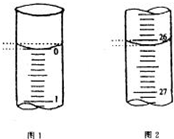 中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>W>Y>X | |
| B. | X的简单氢化物与足量W单质在光照条件下反应生成物均为气体 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | Y的最高价氧化物对应的水化物可与其简单氢化物发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均为ⅠA族元素,最外层均有1个电子 | |
| B. | 单质的还原性:Li>Na>K>Rb>Cs | |
| C. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| D. | 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com