

| A. | 铜电极应与X相连接 | |
| B. | H十透过质子交换膜由右向左移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
分析 根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应;在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,以此解答该题.
解答 解:甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,
A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故A错误;
B.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,即由左向右移动,故B错误;
C.当N电极消耗0.25 mol氧气时,则转移0.25×4=1mol电子,所以铁电极增重$\frac{1}{2}$mol×64g/mol=,故C错误;
D.32gH2NCONH2在负极M上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,故D正确.
故选D.
点评 本题考查了原电池原理以及电镀原理,侧重于学生的分析、计算能力的考查,明确原电池正负极上得失电子、电解质溶液中阴阳离子移动方向即可解答,难度中等.


科目:高中化学 来源: 题型:选择题
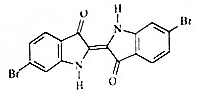 地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )
地中海沿岸出产的一种贵重染料经化学分析,其主要组成的结构如图所示,下列说法不正确的是( )| A. | 属于烃的衍生物 | |
| B. | 分子式为C16H8O2N2Br2 | |
| C. | 1mol该有机物与H2加成最多消耗9molH2 | |
| D. | 该有机物溴元素检验可将有机物与碱液共热后,直接加入硝酸银溶液,观察是否有浅黄色沉淀生成. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
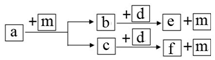 短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z<Y | B. | 阴离子的还原性:Y>W | ||
| C. | 简单气态氢化物的热稳定性:Y>X | D. | W2Y2 中含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 含4.9 g H2SO4与4.9 g H3PO4的混合溶液中氧原子数为0.4NA | |
| C. | 常温下,0.1 mol C2H4分子中含共用电子对数目为0.6NA | |
| D. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
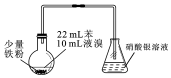
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 烧瓶中反应发生后,有白雾产生,继而充满红棕色气体 | |
| C. | 实验加入试剂的顺序可以是:苯、液溴、铁粉 | |
| D. | 为了增强验证HBr的实验效果,可将锥形瓶中的导管插入溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品在潮湿空气中更易锈蚀 | |
| B. | 二氧化硅常用于制造光导纤维 | |
| C. | 实验室中经过滤可得到纳米碳酸钙固体 | |
| D. | 聚乙烯可作食品包装材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH+H2SO4═Na2SO4+2H2O | B. | 2SO2+O2+2H2O═2H2SO4 | ||
| C. | Cu+2H2SO4$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | D. | C+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2SO2↑+CO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com