
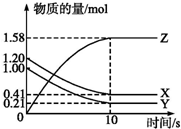
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:分析 由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X+Y?2Z,以此解答该题.
解答 解:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X+Y?2Z,
故答案为:X+Y?2Z;
(2)反应开始到10s,用Z表示的反应速率为:v=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),
故答案为:0.079mol/(L•s);
(3)反应开始到10s时,Y的转化率为$\frac{1.0mol-0.21mol}{1.0mol}$×100%=79%,
故答案为:79%.
点评 本题考查物质的量随时间的变化曲线,以及化学平衡的计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意把握化学方程式的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3胶体 | |
| B. | 胶体区别于其它分散系的本质特征是胶体粒子的直径大小 | |
| C. | 用过滤的方法可以分离和提纯胶体 | |
| D. | 煮鸡蛋的过程中发生了胶体的电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 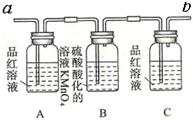 | 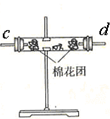 | 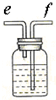 | 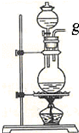 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
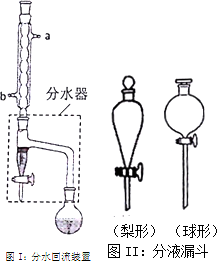 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均反应速率为v(PCl3)=0.0064 mol/(L•s) | |
| B. | 若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80% | |
| D. | 相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
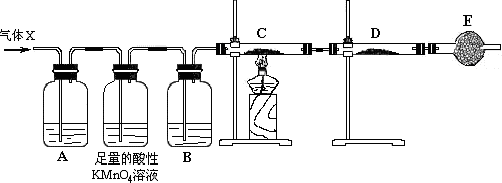
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com