
解析:设加入A的物质的量为x,生成的B中又分解的物质的量为y。
A(g) ![]() 2B(g)
2B(g)
反应前的物质的量浓度/mol·L-1 x 0
转化的物质的量浓度/mol·L-1 y 2y
平衡时的物质的量浓度/mol·L-1 x-y 2y
2B(g) ![]() C(g)+2D(g)
C(g)+2D(g)
反应前的物质的量浓度/mol·L-1 2y 0 0
转化的物质的量浓度/mol·L-1 z 0.5z z
平衡时的物质的量浓度/mol·L-1 2y-z 0.5z z
根据题意:
0.3=x-y ①
0.2=2y-z ②
0.05= 0.5z ③
由①②③解出:x=0.45 mol·L-1。
n(A)=0.45 mol·L-1×
答案:B


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:2012-2013年黑龙江哈尔滨第十二中学高二上学期期末考试化学试卷(带解析) 题型:单选题
一定条件下,在2 L的密闭容器中通入4.0 mol的N2和适量的H2,发生反应:N2(g)+3H2(g) 2NH3(g)。经过5s后,测得N2剩余2.0 mol,在这5S内N2的反应速率为
2NH3(g)。经过5s后,测得N2剩余2.0 mol,在这5S内N2的反应速率为
A.0.3 mol L-1 L-1 s-1 s-1 | B.0.2mol L-1 L-1 s-1 s-1 |
C.0.4 mol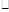 L-1 L-1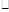 s-1 s-1 | D.0.5 mol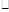 L-1 L-1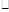 s-1 s-1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三下学期二模化学试卷(解析版) 题型:填空题
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三4月高考预测(二模)化学试卷(解析版) 题型:填空题
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
查看答案和解析>>
科目:高中化学 来源:2014届黑龙江哈尔滨第十二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,在2 L的密闭容器中通入4.0 mol的N2和适量的H2,发生反应:N2(g)+3H2(g) 2NH3(g)。经过5s后,测得N2剩余2.0 mol,在这5S内N2的反应速率为
2NH3(g)。经过5s后,测得N2剩余2.0 mol,在这5S内N2的反应速率为
A.0.3 mol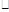 L-1
L-1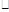 s-1 B.0.2mol
s-1 B.0.2mol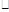 L-1
L-1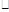 s-1
s-1
C.0.4 mol L-1
L-1 s-1 D.0.5 mol
s-1 D.0.5 mol L-1
L-1 s-1
s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com