
”¾ĢāÄæ”æĻĀĮŠĒśĻß·Ö±š±ķŹ¾ŌŖĖŲµÄijÖÖŠŌÖŹÓėŗĖµēŗÉŹżµÄ¹ŲĻµ£ØZĪŖŗĖµēŗÉŹż£¬YĪŖŌŖĖŲµÄÓŠ¹ŲŠŌÖŹ£®£©
£Ø1£©¢ń”¢°ŃÓėĻĀĆęµÄŌŖĖŲÓŠ¹ŲŠŌÖŹĻą·ūµÄĒśĻߵıźŗÅĢīČėĻąÓ¦ĄØŗÅÖŠ£ŗa.¢ņA×åŌŖĖŲµÄ×īĶā²ćµē×ÓŹż £®
b.µŚČżÖÜĘŚŌŖĖŲµÄ×īøß»ÆŗĻ¼Ū £®
c.µŚČżÖÜĘŚĄė×ÓNa+”¢Mg2+”¢Al3+”¢P3©”¢S2©”¢Cl©µÄĄė×Ó°ė¾¶ £®
d.µŚ¶ž”¢ČżÖÜĘŚŌŖĖŲĖęŌ×ÓŠņŹżµŻŌöŌ×Ó°ė¾¶µÄ±ä»Æ £®
£Ø2£©¢ņ”¢ÓŠĻĀĮŠĪļÖŹ£ŗ¢Ł ![]() C£»¢Ś
C£»¢Ś ![]() K£»¢Ū
K£»¢Ū ![]() Ca£»¢Ü
Ca£»¢Ü ![]() C£»¢Ż
C£»¢Ż ![]() N£»¢Ž
N£»¢Ž ![]() Ar£®ĘäÖŠ£ŗ a.»„ĪŖĶ¬Ī»ĖŲµÄŹĒ £®
Ar£®ĘäÖŠ£ŗ a.»„ĪŖĶ¬Ī»ĖŲµÄŹĒ £®
b.ÖŹĮæŹżĻąµČ£¬µ«²»ÄÜ»„³ĘĶ¬Ī»ĖŲµÄŹĒ £®
c.ÖŠ×ÓŹżĻąµČ£¬µ«ÖŹ×ÓŹż²»ĻąµČµÄŹĒ £®
”¾“š°ø”æ
£Ø1£©B£»C£»E£»G
£Ø2£©¢Ł¢Ü£»¢Ū¢Ž£»¢ŚŗĶ¢Ū£¬¢ÜŗĶ¢Ż
”¾½āĪö”æ½ā£ŗ£Ø1£©¢ń£®a.Ķ¬Ņ»Ö÷×åŌŖĖŲ¼Ūµē×ÓŹżĻąµČ£¬ÓėŌ×ÓŠņŹżĪŽ¹Ų£¬µŚIIA×åŌŖĖŲ¼Ūµē×ÓŹż¶¼ŹĒ2£¬ĖłŅŌ“š°øŹĒ£ŗB£»b.µŚČżÖÜĘŚŌŖĖŲµÄ×īøßÕż»ÆŗĻ¼ŪĖę×ÅŌ×ÓŠņŹżŌö“ó¶ųŌö“ó£¬Ļ”ÓŠĘųĢåµÄ»ÆŗĻ¼ŪĪŖ0£»ĖłŅŌ“š°øŹĒ£ŗC£»c.µē×Ó²ćŌ½¶ą£¬Ąė×Ó°ė¾¶Ō½“󣬵ē×Ó²ć½į¹¹ĻąĶ¬µÄĄė×ÓĘäĄė×Ó°ė¾¶Ėę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õŠ”£¬Na+”¢Mg2+”¢Al3+µÄĄė×Ó°ė¾¶ŅĄ“Ī¼õŠ”£¬P3©”¢S2©”¢Cl©µÄĄė×Ó°ė¾¶ŅĄ“Ī¼õŠ”£¬ŅõĄė×Ó°ė¾¶“óÓŚŃōĄė×Ó°ė¾¶£¬ĖłŅŌE·ūŗĻ£»ĖłŅŌ“š°øŹĒ£ŗE£»d.µē×Ó²ćŌ½¶ą£¬°ė¾¶Ō½“󣬵ŚČżÖÜĘŚµÄŌ×Ó°ė¾¶“óÓŚµŚ¶žÖÜĘŚ£¬Ķ¬ÖÜĘŚŌ×Ó°ė¾¶Ėę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õŠ”£¬ĖłŅŌG·ūŗĻ£»
ĖłŅŌ“š°øŹĒ£ŗG£»£Ø2£©¢ņ£®¢Ł ![]() CµÄÖŹ×ÓŹżĪŖ6£¬ÖŹĮæŹżĪŖ12£¬ÖŠ×ÓŹż=12©6=6£»
CµÄÖŹ×ÓŹżĪŖ6£¬ÖŹĮæŹżĪŖ12£¬ÖŠ×ÓŹż=12©6=6£»
¢Ś ![]() KµÄÖŹ×ÓŹżĪŖ19£¬ÖŹĮæŹżĪŖ39£¬ÖŠ×ÓŹżĪŖ39©19=20£»
KµÄÖŹ×ÓŹżĪŖ19£¬ÖŹĮæŹżĪŖ39£¬ÖŠ×ÓŹżĪŖ39©19=20£»
¢Ū ![]() CaµÄÖŹ×ÓŹżĪŖ20£¬ÖŹĮæŹżĪŖ40£¬ÖŠ×ÓŹżĪŖ40©20=20£»
CaµÄÖŹ×ÓŹżĪŖ20£¬ÖŹĮæŹżĪŖ40£¬ÖŠ×ÓŹżĪŖ40©20=20£»
¢Ü ![]() CµÄÖŹ×ÓŹżĪŖ6£¬ÖŹĮæŹżĪŖ13£¬ÖŠ×ÓŹżĪŖ13©6=7£»
CµÄÖŹ×ÓŹżĪŖ6£¬ÖŹĮæŹżĪŖ13£¬ÖŠ×ÓŹżĪŖ13©6=7£»
¢Ż ![]() NµÄÖŹ×ÓŹżĪŖ7£¬ÖŹĮæŹżĪŖ14£¬ÖŠ×ÓŹżĪŖ14©7=7£»
NµÄÖŹ×ÓŹżĪŖ7£¬ÖŹĮæŹżĪŖ14£¬ÖŠ×ÓŹżĪŖ14©7=7£»
¢Ž ![]() ArµÄÖŹ×ÓŹżĪŖ18£¬ÖŹĮæŹżĪŖ40£¬ÖŠ×ÓŹżĪŖ40©18=22£® a.»„ĪŖĶ¬Ī»ĖŲµÄŹĒ¢Ł¢Ü£»ĖłŅŌ“š°øŹĒ£ŗ¢Ł¢Ü£»b.ÖŹĮæŹżĻąµČ£¬µ«²»ÄÜ»„³ĘĶ¬Ī»ĖŲµÄŹĒ¢Ū¢Ž£»ĖłŅŌ“š°øŹĒ£ŗ¢Ū¢Ž£»c.ÖŠ×ÓŹżĻąµČ£¬µ«ÖŹ×ÓŹż²»ĻąµČµÄŹĒ¢ŚŗĶ¢Ū£¬¢ÜŗĶ¢Ż£»ĖłŅŌ“š°øŹĒ£ŗ¢ŚŗĶ¢Ū£¬¢ÜŗĶ¢Ż£®
ArµÄÖŹ×ÓŹżĪŖ18£¬ÖŹĮæŹżĪŖ40£¬ÖŠ×ÓŹżĪŖ40©18=22£® a.»„ĪŖĶ¬Ī»ĖŲµÄŹĒ¢Ł¢Ü£»ĖłŅŌ“š°øŹĒ£ŗ¢Ł¢Ü£»b.ÖŹĮæŹżĻąµČ£¬µ«²»ÄÜ»„³ĘĶ¬Ī»ĖŲµÄŹĒ¢Ū¢Ž£»ĖłŅŌ“š°øŹĒ£ŗ¢Ū¢Ž£»c.ÖŠ×ÓŹżĻąµČ£¬µ«ÖŹ×ÓŹż²»ĻąµČµÄŹĒ¢ŚŗĶ¢Ū£¬¢ÜŗĶ¢Ż£»ĖłŅŌ“š°øŹĒ£ŗ¢ŚŗĶ¢Ū£¬¢ÜŗĶ¢Ż£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijӊ»śĪļŗ¬Ģ¼85.7%£¬ŗ¬Ēā14.3%£¬Ļņ80gŗ¬äå5%µÄäåĖ®ÖŠĶØČėøĆÓŠ»śĪļ£¬äåĖ®Ē”ŗĆĶźČ«ĶŹÉ«£¬“ĖŹ±ŅŗĢå×ÜÖŹĮæĪŖ81.4g£®Ēó£ŗ
£Ø1£©ÓŠ»śĪļµÄ·Ö×ÓŹ½£®
£Ø2£©¾²ā¶Ø£¬øĆÓŠ»śĪļ·Ö×ÓÖŠÓŠĮ½øö©CH3 £¬ ŹŌŠ“³öĖüµÄ½į¹¹¼ņŹ½£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·Ö×ÓÖŠĖłÓŠŌ×Ó¾łĀś×ć×īĶā²ć8µē×Ó½į¹¹µÄŹĒ
A. LiClB. NCl3C. PCl5D. BF3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĢõ¼žĻĀ£¬¶ŌÓŚĆܱÕČŻĘ÷ÖŠ½ųŠŠµÄ·“Ó¦P£Øg£©+Q£Øg£©![]() R£Øg£©+S£Øg£©ĻĀĮŠĖµ·ØÖŠæÉŅŌ³ä·ÖĖµĆ÷ÕāŅ»·“Ó¦ŅŃ¾“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
R£Øg£©+S£Øg£©ĻĀĮŠĖµ·ØÖŠæÉŅŌ³ä·ÖĖµĆ÷ÕāŅ»·“Ó¦ŅŃ¾“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
A. P”¢Q”¢R”¢SµÄÅضČĻąµČ
B. P ”¢Q”¢R”¢SŌŚĆܱÕČŻĘ÷ÖŠ¹²“ę
C. P”¢Q”¢R”¢SµÄÅØ¶Č²»ŌŁ±ä»Æ
D. ÓĆPµÄÅØ¶Č±ä»Æ±ķŹ¾µÄ»ÆѧĖŁĀŹÓėÓĆQµÄÅØ¶Č±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĻąµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCO2µÄ׏Ō“»ÆĄūÓĆŹĒ½ā¾öĪĀŹŅŠ§Ó¦µÄÖŲŅŖĶ¾¾¶£¬ČēĶ¼ŹĒŌŚŅ»¶ØĢõ¼žĻĀÓĆNH3²¶»ńCO2Éś³ÉÖŲŅŖ»Æ¹¤²śĘ·Čż¾ŪĒčĖįµÄ·“Ó¦£ŗ 
ĻĀĮŠÓŠ¹ŲČż¾ŪĒčĖįµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.·Ö×ÓŹ½ĪŖC3H6N3O3
B.·Ö×ÓÖŠ¼Čŗ¬¼«ŠŌ¼ü£¬ÓÖŗ¬·Ē¼«ŠŌ¼ü
C.ŹōÓŚ¹²¼Ū»ÆŗĻĪļ
D.Éś³ÉøĆĪļÖŹµÄÉĻŹö·“Ó¦ĪŖÖŠŗĶ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢W”¢Q”¢R¾łĪŖĒ°ĖÄÖÜĘŚŌŖĖŲ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®ĘäĻą¹ŲŠÅĻ¢ČēĻĀ±ķĖłŹ¾£ŗ
XŌŖĖŲµÄ»łĢ¬Ō×ÓÖŠµē×Ó·Ö²¼ŌŚČżøö²»Ķ¬µÄÄܼ¶ÖŠ£¬ĒŅĆæøöÄܼ¶ÖŠµÄµē×Ó×ÜŹżĻąĶ¬ |
YŌŖĖŲµÄĘųĢ¬Ēā»ÆĪļÓėĘä×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÄÜ·¢Éś»ÆŗĻ·“Ó¦ |
ZŌŖĖŲµÄ×åŠņŹżŹĒĘäÖÜĘŚŹżµÄČż±¶ |
WŌ×ӵĵŚŅ»ÖĮµŚĮłµēĄėÄÜ·Ö±šĪŖ£ŗI1=578KJmol©1 I2=1817KJmol©1 I3=2745KJmol©1I4=11575KJmol©1 I5=14830KJmol©1 I6=18376KJmol©1 |
QĪŖĒ°ĖÄÖÜĘŚÖŠµēøŗŠŌ×īŠ”µÄŌŖĖŲ |
ŌŖĖŲRĪ»ÓŚÖÜĘŚ±ķµÄµŚ10ĮŠ |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©YŌŖĖŲµÄ»łĢ¬Ō×ÓÖŠĪ“³É¶Ōµē×ÓŹżĪŖ£»X”¢Y”¢ZČżÖÖŌŖĖŲŌ×ӵĵŚŅ»µēĄėÄÜÓÉŠ”µ½“óµÄĖ³ŠņĪŖ£ØÓĆŌŖĖŲ·ūŗűķŹ¾£©£®
£Ø2£©WµÄĀČ»ÆĪļµÄČŪµć±ČQµÄĀČ»ÆĪļµÄČŪµć£ØĢī”°øß”±»ņ”°µĶ”±£©£¬ĄķÓÉŹĒ
£Ø3£©¹āĘ×Ö¤ŹµŌŖĖŲWµÄµ„ÖŹÓėĒæ¼īŠŌČÜŅŗ·“Ó¦ÓŠ[W£ØOH£©4]©Éś³É£¬Ōņ[W£ØOH£©4]©ÖŠ“ęŌŚ£ØĢī×ÖÄø£© £® a£®¼«ŠŌ¹²¼Ū¼ü b£®·Ē¼«ŠŌ¹²¼Ū¼ü c£®ÅäĪ»¼ü d£®Ēā¼ü
£Ø4£©ŗ¬ÓŠX”¢RŗĶĆ¾ČżÖÖŌŖĖŲµÄijÖÖ¾§Ģå¾ßÓŠ³¬µ¼ŠŌ£¬Ęä½į¹¹ČēĶ¼ĖłŹ¾£®ŌņøĆ¾§ĢåµÄ»ÆѧŹ½ĪŖ£»¾§ĢåÖŠĆæøöĆ¾Ō×ÓÖÜĪ§¾ąĄė×ī½üµÄRŌ×ÓÓŠøö£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĻĀĶ¼ĪŖĖÄÖÖĮ£×ӵĽį¹¹Ź¾ŅāĶ¼£¬Ķź³ÉŅŌĻĀĢīæÕ£ŗ
ŹōÓŚŃōĄė×Ó½į¹¹µÄĮ£×ÓŹĒ£ØĢī×ÖÄøŠņŗÅ£¬ĻĀĶ¬£©£»AĮ£×ӵİė¾¶BĮ£×ӵİė¾¶£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©£®
£Ø2£©ÓŠ»śĪļM¾¹żĢ«Ńō¹ā¹āÕÕæÉ×Ŗ»Æ³ÉN£¬×Ŗ»Æ¹ż³ĢČēĻĀ£ŗ 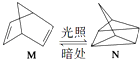 ”÷H=+88.6kJmol©1ŌņM”¢NĻą±Č£¬½ĻĪČ¶ØµÄŹĒ £®
”÷H=+88.6kJmol©1ŌņM”¢NĻą±Č£¬½ĻĪČ¶ØµÄŹĒ £®
£Ø3£©ÓÉĒāĘųŗĶŃõĘų·“Ӧɜ³É1molĖ®ÕōĘų·Å³öČČĮæ241.8kJ£¬Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ £®
£Ø4£©Ņ»¶ØĪĀ¶ČĻĀŌŚÄ³¶ØČŻČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ2A£Øg£©+3B£Øg£©2C£Øg£©£¬æŖŹ¼Ź±£¬AµÄÅضČĪŖ2molL©1 £¬ BµÄÅضČĪŖ4molL©1 £¬ 2minŗó£¬AµÄÅØ¶Č¼õÉŁ0.8molL©1 £¬ Ōņ¢Łv£ØB£©= £¬ v£ØC£©= £®
¢ŚŌŚ2minÄ©£¬CµÄÅØ¶ČŹĒ £¬ BµÄÅØ¶ČŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĮņĖį·Ö½āĮ×Ī²æó[Ö÷ŅŖ³É·ŻĪŖCa5(PO4)3F]æÉÖʵĆÖŠĒæĖįĮ×ĖįH3PO4”£Ēė»Ų“š£ŗ
£Ø1£©Na2HPO4ČÜŅŗ³Ź¼īŠŌ£¬ŌņŌŚøĆČÜŅŗÖŠc(H2PO4£)_____c(PO43£)£ØĢī”°>”±”¢”°<”±”¢”°£½”±£©£¬ĻņNa2HPO4ČÜŅŗÖŠ¼ÓČė×ćĮæµÄCaCl2ČÜŅŗ£¬ČÜŅŗĻŌĖįŠŌ£¬ČÜŅŗĻŌĖįŠŌµÄŌŅņŹĒ(“ÓµēĄėĘ½ŗāŅĘ¶Æ½Ē¶Č·ÖĪö)£ŗ________________________”£
£Ø2£©Ca5(PO4)3F(s) +OH£(aq)![]() Ca5(PO4)3(OH) (s)+F££¬øĆĪĀ¶ČĻĀ£¬ČÜŅŗÖŠc(F£)ĖęČÜŅŗµÄpHŗĶĪĀ¶Č£ØT£©µÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£
Ca5(PO4)3(OH) (s)+F££¬øĆĪĀ¶ČĻĀ£¬ČÜŅŗÖŠc(F£)ĖęČÜŅŗµÄpHŗĶĪĀ¶Č£ØT£©µÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£
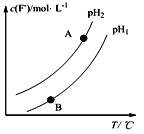
Ōņ£ŗŹŹµ±______ĪĀ¶ČÓŠĄūÓŚĮ×Ī²æó×Ŗ»ÆĪŖōĒ»łĮ×»ŅŹÆ£ØĢī”°Éżøß”±”¢”°½µµĶ”±£©£»pH1___pH2£ØĢī”°>”±”¢”°<”±”¢”°£½”±£©£»A”¢BĮ½µćµÄČÜŅŗÖŠF”ŖµÄĖŁĀŹv(A)____v(B)£ØĢī”°>”±”¢ ”°<”±”¢”°£½”±£©£»
£Ø3£©ŅŃÖŖ£ŗ25”ꏱ£¬H3PO4µÄµēĄėĘ½ŗā³£Źż£ŗK1£½7.52”Į10£3£»K2£½6.23”Į10£8£»K3£½6.23”Į10£13£¬Ōņ£ŗH3PO4(aq)+OH£(aq)![]() H2PO4£(aq)+H2O (l)µÄĘ½ŗā³£ŹżK=____________”£
H2PO4£(aq)+H2O (l)µÄĘ½ŗā³£ŹżK=____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·Ö±šĻņĻĀĮŠČÜŅŗÖŠ¼ÓČėÉŁĮæµÄ¹żŃõ»ÆÄĘ¹ĢĢ壬²»»į³öĻÖ»ė×ĒµÄŹĒ ( )
A£®Na2CO3ČÜŅŗ
B£®FeCl3ČÜŅŗ
C£®±„ŗĶCa(OH)2ČÜŅŗ
D£®CuSO4ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com