
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
分析 A.只含共价键的物质可能是单质;
B.HF分子间含有氢键,沸点最高;
C.微粒间通过离子键形成的化合物属于离子化合物;
D.金属与非金属之间可能形成共价键.
解答 解:A.只含共价键的物质可能是单质,如O2,故A错误;
B.HF中含有氢键,沸点最高,HCl、HBr、HI不存在氢键,则沸点依次升高,故B错误;
C.微粒间通过离子键形成的化合物属于离子化合物,所以含有离子键的化合物一定是离子化合物,故C正确;
D.金属与非金属之间可能形成共价键,如AlCl3中,铝元素与氯元素之间形成共价键,故D错误.
故选C.
点评 本题考查化学键及化合物的类别、氢键和分子间作用力,题目难度不大,熟悉化学键的形成及特殊物质中的化学键即可解答,注意利用实例来分析解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
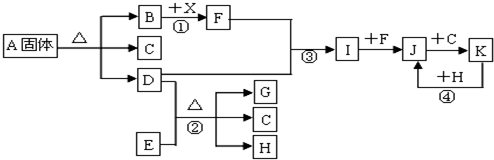
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾一淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 | |
| C. | 测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 向硅酸钠溶液中,滴入硫酸,可以验证S的非金属性强于Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
 .元素⑩名称为溴.
.元素⑩名称为溴.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
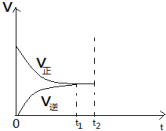 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
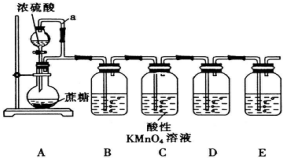
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com