
| A. | N2 | B. | NO | C. | CH4 | D. | NH3 |
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
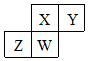 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将酒精和1 mol/L的硫酸溶液混合,迅速升温到170℃制取乙烯气体 | |
| B. | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡,鉴别苯和四氯化碳 | |
| C. | 酒精与碘水混合并振荡,萃取碘水中的碘 | |
| D. | 在苯中加铁粉后再加溴水并振荡,制取溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极和电解池的阳极所发生的反应 | |
| B. | 原电池的阳极和电解池的负极所发生的反应 | |
| C. | 原电池的负极和电解池的阳极所发生的反应 | |
| D. | 原电池的负极和电解池的阴极所发生的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取乳酸基塑料的原料比较低廉且广泛 | |
| B. | 乳酸基塑料属于金属材料 | |
| C. | 使用乳酸基塑料制品可以减少“白色污染” | |
| D. | 乳酸基塑料属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠晶体溶于水中 | |
| B. | NH4HCO3(s)分解生成NH3(g)、CO2(g)和H2O(g) | |
| C. | 水结成冰 | |
| D. | 干冰升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.
在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 两极上溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1g,铜片上析出1g氢气 | |
| D. | 电解质溶液pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com