
| A. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2NO2+H2O═2HNO3+NO | D. | 2F2+2H2O═4HF+O2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
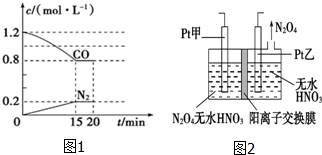 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg17Al12是离子化合物 | |
| B. | 为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气 | |
| C. | 732 g的合金能吸收380.8 L氢气 | |
| D. | 该合金的熔点比镁和铝的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | N点时的反应速率一定比M点快 | |
| C. | 降低温度,H2的转化率可达到100% | |
| D. | 工业用此法制取甲烷应采用更高的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com