
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:阅读理解
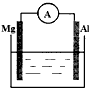
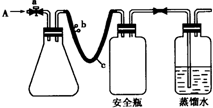 (2012?南通模拟)实验室用下列方法测定某水样中O2的含量.
(2012?南通模拟)实验室用下列方法测定某水样中O2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
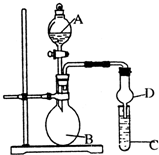 已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com