
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
分析 (1)根据实验1、2、3的异同点解答;
(2)根据降低温度和使用催化剂对反应速率的影响解答;
(3)慢反应中有I2生成,使溶液变蓝色,而快反应中消耗I2,慢反应决定反应速率,慢反应中生成I2大于快反应中消耗的I2,可以观察到溶液变蓝色;
(4)将第一个方程式与第二个方程式相减再除以2,焓变进行相应改变,正极上得电子发生还原反应.
解答 解:(1)对照实验1和2发现,实验2取的0.20mol•L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水,
故答案为:2;理由是保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的;
(2)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,
故答案为: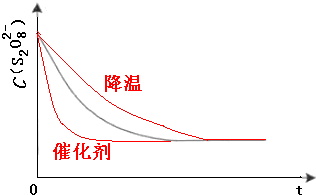 ;
;
(3)慢反应中有I2生成,使溶液变蓝色,而快反应中消耗I2,慢反应决定反应速率,当溶液中的 S2O32-或Na2S2O3耗尽后,碘才能与淀粉作用显示蓝色;
根据I2+2S2O32-═S4O62-+2I- (快)可知,1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2可知,生成1mol碘需为1molS2O82-,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82-)<2:1,
故答案为:S2O32-或Na2S2O3;<2:1;
(4)①4Li(s)+O2 (g)=2Li2O(s)△H1
②4LiI(s)+O2 (g)=2I2 (s)+2Li2O(s)△H2
将方程式$\frac{①-②}{2}$得2Li(s)+I2 (s)=2LiI(s),△H=$\frac{△{H}_{1}-△{H}_{1}}{2}$;该反应中碘得电子发生还原反应,所以碘是在正极上发生反应,
故答案为:$\frac{△{H}_{1}-△{H}_{1}}{2}$;正极.
点评 本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,注意对实验现象的分析,化学反应速率与图象的关系,盖斯定律的应用,本题综合性较强.


科目:高中化学 来源: 题型:解答题
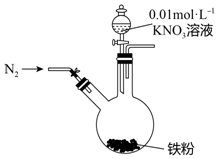 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与3molNaOH反应 | |
| C. | 分子式为C23H24O6 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| B. | 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| C. | 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2 NA | |
| D. | 60g SiO2和12g金刚石中各含有4NA个Si-O键和C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (3)白磷 (4)氯气 (5)
(3)白磷 (4)氯气 (5)

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )是苯的含氧衍生物,在化妆品中可作防腐剂.其一种同分异构体M,满足如下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种.尼泊金甲酯的另一种同分异构体N,能发生银镜反应,也能与NaOH溶液反应生C8H7O3Na.下列推论合理的是( )
)是苯的含氧衍生物,在化妆品中可作防腐剂.其一种同分异构体M,满足如下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种.尼泊金甲酯的另一种同分异构体N,能发生银镜反应,也能与NaOH溶液反应生C8H7O3Na.下列推论合理的是( )| A. | lmol尼泊金甲酯能与1molNaOH反应生成对应的钠盐 | |
| B. | 符合题述条件的有机物M有两种 | |
| C. | 有机物N一定不能发生酯化反应 | |
| D. | 符合条件的有机物M易溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁和铝的混合物0.1mol溶于100mL 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图
将镁和铝的混合物0.1mol溶于100mL 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液.在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com