

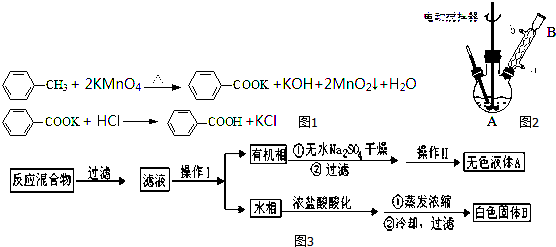
分析 A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)组装好仪器后,实验室制备气体发生的反应,装置不能漏气;
(2)装置B中试剂是干燥氢气的干燥剂,可以选择浓硫酸,D中氢气与SiHCl3反应生成Si与HCl;
(3)吸收SiHCl3及HCl,并防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,可以计算生成HCl的物质的量,再根据方程式计算参加反应SiHCl3的质量,进而计算其利用率.
解答 解:A装置制备氢气,B装置中盛放浓硫酸干燥氢气,防止SiHCl3水解,利用生成的氢气排尽装置内空气,防止安全事故的发生,再在D中反应得到高纯硅,同时生成HCl气体,D装置中四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,最后可以利用燃烧法处理氢气.
(1)组装好仪器后,实验室制备气体发生的反应,应先进行的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)①B装置中盛放浓硫酸干燥氢气,故答案为:浓硫酸;
②D中氢气与SiHCl3反应生成Si与HCl,反应方程式为:SiHCl3+H2 $\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$ Si+3HCl;
(3)装置E的作用为:四氯化碳吸收未反应的SiHCl3,氢氧化钠溶液吸收HCl,还可以防止倒吸,
故答案为:四氯化碳吸收未反应的SiHCl3;防止倒吸;
(4)先通入氢气,排尽装置中空气,再加热石英管,提高原理利用率,反应完毕停止通氢气,②打开K1,装置A中反应一段时间,①加热装置D至1357K:;⑤加热装置C,打开K2,滴加6.5mLSiHC13;④关闭K2;③关闭K1,其合理顺序为:②①⑤④③,
故答案为:②①⑤④③;
(5)滴定终点时,氢氧化钠完全反应,溶液红色褪去,且半分钟不变色;
氢氧化钠物质的量等于生成的HCl与后加入HCl的物质的量之和,则生成HCl的物质的量=0.2L×1mol/L-0.02L×0.1mol/L×$\frac{200ml}{20ml}$=0.18mol,由SiHCl3+H2 $\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,可知参加反应SiHCl3为 $\frac{0.18mol}{3}$=0.06mol,故SiHCl3的利用率为 $\frac{0.06mol×135.5g/mol}{6.5ml×1.34g/mol}$×100%=93.34%,
故答案为:溶液红色褪去,且半分钟不变色;93.34.
点评 本题考查物质制备实验方案设计,侧重考查学生获取信息和利用、基本操作能力,明确实验原理是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 任意条件下,16g O3所含的原子数为NA | |
| C. | 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA | |
| D. | 46 g二氧化氮和46 g四氧化二氮含有的原子数均是6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
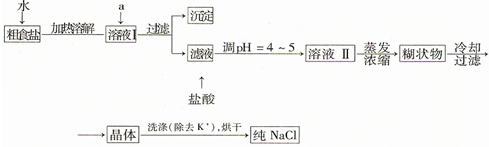
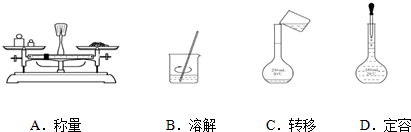
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
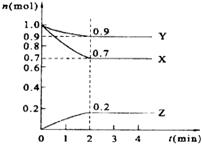 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
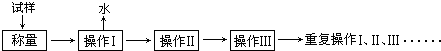
 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c. 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.5 mol•L-1•s-1 | ||
| C. | v(C)=1.8 mol•L-1•min-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com