
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
【答案】(1)检验装置的气密性 ;Cu + 2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O ; 酸性的KMnO4溶液 ;A中KMnO4溶液没有完全褪色;盛有Na2SiO3溶液的试管中出现白色沉淀
CuSO4 +SO2↑+2H2O ; 酸性的KMnO4溶液 ;A中KMnO4溶液没有完全褪色;盛有Na2SiO3溶液的试管中出现白色沉淀
(2)2H2S+SO2=3S↓+2H2O

Ba2+ +SO2 +Cl2 +2H2O=BaSO4↓+4H+ +2Cl-
【解析】试题分析:(1)①装置A中反应制备气体,在加入药品之前需要检验装置的气密性;
②铜与浓硫酸反应生成硫酸铜和二氧化硫、水,所以反应的方程式为Cu + 2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O;装置A的作用是除去二氧化硫,防止干扰二氧化碳与硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
CuSO4 +SO2↑+2H2O;装置A的作用是除去二氧化硫,防止干扰二氧化碳与硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
③利用较强酸制备较弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,说明二氧化硫已经完全被氧化,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应的化学方程式为2H2S+SO2=3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2+ +SO2 +Cl2 +2H2O=BaSO4↓+4H+ +2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型的无机非金属材料,工业上制备原理如下:Al2O3+N2+3C![]() 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为___________;AlN产品中常含有碳等不与NaOH溶液反应的杂质。为了分析某A1N样品中A1N的含量。某实验小组设计了如下三种实验方案。知:A1N+NaOH+H2O=NaAlO2+NH3↑
【方案1】有人想用下列A、B两个装置中的一种(在通风橱内进行)。只需进行简单而又必要的数据测定,用差量法就可测定样品中A1N的质量分数,较合理的装置是:___________(填代号)。

【方案2】取一定量(m1)的样品,用以下装置测定样品中A1N的纯度(夹持装置己略去)。

(1)上图C装置中球形干燥管的作用是___________;
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性:再加入实验药品,接下来关闭K1打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间。
请回答:I、需测定___________(填A、B、C)装置反应前后的质量变化。Ⅱ、通入氮气的目的是____________。
【方案3】按以下步骤测定样品中A1N的含量:
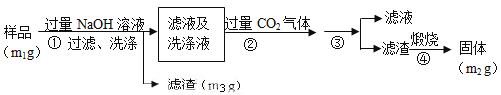
(1)步骤②生成沉淀的离子方程式为___________;
(2)步骤③的操作是___________,A1N的纯度是___________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:

(1)操作Ⅱ中,通入硫化氢至饱和的目的是______________;在溶液中用硫酸酸化至pH=2的目的是______________。
(2)滤渣Ⅱ的主要成分是______________。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______________(填仪器名称).
②判断此滴定实验达到终点的方法是______________。
③计算上述样品中FeSO47H2O的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
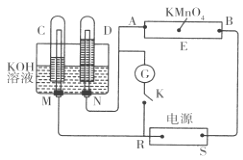
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是_________________________。
(3)理论上稀的强酸溶液与强碱溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:_______________。
(4)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”),简述理由:________________________________________________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂。
已知:氯化铜容易潮解.

I.实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜。
(1)石棉绒的作用是 ;B装置中的试剂是 。E和F装置及试剂可用_______ 替换(填装置及所装试剂)。
(2)当Cl2排尽空气后,加热D。则D中发生反应的化学方程式为 。
(3) 若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是 (一种即可)。
Ⅱ.另取纯净CuC l2固体用于制备CuCl。

(4)溶解时加入HCl溶液的目的主要是 (结合离子方程式回答)。
(5)若接上述操作用10. 0mol/L的HCl代替0.2mol/L HCl,通人SO2后,200. 00mL黄绿色溶液颜色褪去,但无白色沉淀。对此现象:
甲同学提出假设:c(H+)过大。
为验证此假设,可取75.00g CuCl2固体与100mL0.2mol/LHCl及 mL9. 8mol/LH2SO4配制成200. 00mL溶液再按上述操作进行实验。
乙同学查阅资料:体系中存在平衡2Cl-(aq)+CuCl(s)=CuCl32-(aq)。则出现此现象另一可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某烃A在氧气中充分燃烧后,生成化合物B,C各1.2 mol。试回答:
(1)烃A的分子式为_____________.
(2)若取一定量的烃A完全燃烧后,生成B、C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气_____________L.
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有
一种,则烃A的结构简式为______________.
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构________种,任写出其中一种烃A的结构简式____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com