
| A. | 最外层有4个电子的原子都是非金属原子 | |
| B. | 同一主族的两种元素的原子序数之差不可能是44 | |
| C. | COCl2分子和CCl4分子中所有原子都满足最外层8电子结构 | |
| D. | 同主族金属的原子,半径越大,熔点越高 |
分析 A.第ⅣA族元素最外层有4个电子,既有金属元素也有非金属元素;
B.同主族两种元素的原子序数相差2、8、8、18、18、32等或它们的组合;
C.根据最外层电子数来分析原子都满足最外层8电子结构;
D.第ⅠA族中金属的原子半径越大熔点越低.
解答 解:A.第ⅣA族元素最外层有4个电子,其中锡和铅为金属元素,故A错误;
B.同主族两种元素的原子序数相差2、8、8、18、18、32等或它们的组合,则同主族两种元素的原子序数之差可能为:8+8+18=44,故B错误;
C.C原子最外层4个电子,O最外层6个电子,Cl最外层7个电子,COCl2分子和CCl4分子中所有原子都满足最外层8电子结构,故C正确;
D.同一主族中,金属的原子半径越大,其熔点越低,故D错误;
故选C.
点评 本题考查原子的结构与元素周期表的结构,题目难度不大,注意掌握元素周期表的组成特点,明确原子核外电子排布规律,试题培养了学生灵活应用基础知识的能力.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
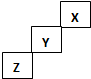
| A. | Z一定是活泼的金属元素 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | Y的气态氢化物最稳定 | |
| D. | Z单质可与盐酸反应置换出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
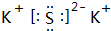 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.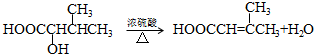 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇含有的分子数为 NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 在含1mol氢氧化铁的胶体中,胶粒数目为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com