
分析 物质是由不同物质组成的为混合物,同种物质组成的为纯净物,一种元素组成的纯净物为单质,不同元素组成的纯净物为化合物,金属元素和氧元素组成的氧化物为金属氧化物,金属阳离子和酸根阴离子构成的化合物为盐.
解答 解:(1)氧气是原子元素组成的纯净物为单质;
(2)空气是不同物质组成的混合物;
(3)碱式碳酸铜是一种物质组成的纯净物属于化合物;
(4)氯酸钾是一种物质组成的纯净物,不同元素组成属于化合物;
(5)硫是一种元素组成的非金属单质;
(6)水是一种物质组成的纯净物,不同元素组成的纯净物为化合物;
(7)氧化镁是一种物质组成的纯净物,属于金属氧化物;
(8)氯化钠是一种物质组成的纯净物,属于不同元素组成的纯净物为化合物;
(9)CO是一种物质组成的纯净物,由不同元素组成为化合物,属于非金属氧化物;
(10)SO2是一种物质组成的纯净物,由不同元素组成为化合物,属于非金属氧化物;
(11)氨水是不同物质组成的混合物;
(12)Mn2O7是一种物质组成的纯净物,属于金属氧化物;
(13)Cu2SO4•5H2O是一种物质组成的纯净物,不同元素组成属于化合物,
其中属于混合物的有(2)(11),属于单质的是(1)(5),属于金属氧化物的有(7)(12),属于盐的有(3)(4)(8)(13),
故答案为:(2)(11),(1)(5),(7)(12),(3)(4)(8)(13);
点评 本题考查物质的分类,题目难度不大,注意纯净物与混合物的区别:是否由一种物质组成,单质和化合物的区别是:是否由同种元素组成,氧化物是由两种元素组成、一种是氧元素.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
氨水中所含的分子和离子有 
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
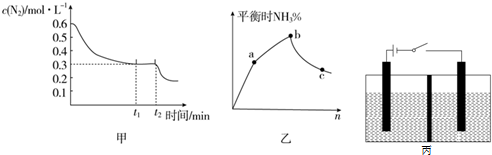
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
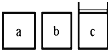 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
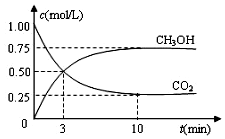 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com