
将铂电极置于KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,下列叙述正确的是
A.通入CH4的电极为正极
B.正极的电极反应式为O2+4H++4e-=2H2O
C.通入CH4的一极的电极反应式为CH4+2O2+4e-=CO2+2H2O
D.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
科目:高中化学 来源:2015-2016学年江西省抚州市高一下5月月考化学试卷(解析版) 题型:填空题
某单烯烃与H2加成后的产物是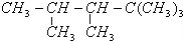 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二6月月考化学试卷(解析版) 题型:选择题
将7.8 g的过氧化钠溶于92.2 g的水中,得到的溶液质量分数为( )
A.7.8% B.8%
C.8.13% D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二6月月考化学试卷(解析版) 题型:选择题
等质量的两份铝分别与足量稀H2SO4和NaOH溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为( )
A.3:2 B.2:3 C.1:1 D.1:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌市三校高二下第四次联考化学试卷(解析版) 题型:填空题
X、Y、Z、W、H为原子序数依次增大的五种短周期元素,它们满足以下条件:元素周期表中,Z与Y相邻,Z与W也相邻; Y、Z和W三种元素的原子最外层电子数之和为17;H的单质常温下为黄绿色气体。请填空:
(1)Z、W、H简单阴离子的半径由大到小的顺序是____________(用离子符号表示)
(2)H的单质通入W的氢化物的水溶液中,可观察到有淡黄色沉淀生成,该现象说明H与W单质的氧化性强弱顺序为____________(用化学式表示)
(3)写出实验室制取H的单质的化学反应方程式________________
(4)X、Y、Z和W可组成一化合物,其原子个数之比为8︰2︰4︰1。其水溶液中各种离子的浓度由大到小的顺序为____________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌市三校高二下第四次联考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2=2Fe3++I2+4Br-
C.用惰性电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D.硫氢化钠水解:HS-+H2O H2S+OH-
H2S+OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省石家庄市高二下期中化学试卷(解析版) 题型:填空题
糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是________________(写名称)。
(2)蛋白质的水解产物具有的官能团是____________________(写结构简式)。
已知A是人体能消化的一种天然高分子化合物,B和C分别是A在不同条件下的水解产物,它们有如下转化关系,请根据该信息完成(3)~(5)小题。
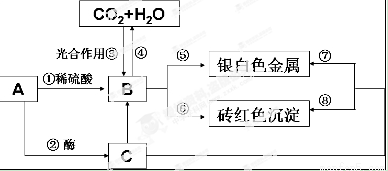
(3)下列说法不正确的是:______________________
A.1molC完全水解可生成2molB
B.工业上常利用反应⑦给热水瓶胆镀银
C.用A进行酿酒的过程就是A的水解反应过程
D.A的水溶液可以发生丁达尔效应
E.反应③属于吸热反应
(4)请设计实验证明A通过反应①已经全部水解,写出操作方法、现象和结论 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省石家庄市高二下期中化学试卷(解析版) 题型:选择题
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如下图。

下列有关绿原酸的说法中不正确的是
A.绿原酸分子中有4个手性碳原子
B.绿原酸能发生显色反应、取代反应和加成反应
C.每摩尔绿原酸最多与4 mol NaOH反应
D.绿原酸分子中所有碳原子都能在同一平面上
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一下期中化学试卷(解析版) 题型:填空题
试回答下列各问题:
(1)如图Ⅰ所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________________________________________________________。
(2)化学反应的能量变化与反应物和生成物的键能有关。
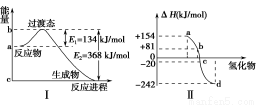
①已知: H2(g)+Cl2(g) = 2HCl(g) ΔH=-185 kJ/mol;
E(H—H)=436 kJ/mol,E(Cl—Cl)=247 kJ/mol,则E(H—Cl)=________。
②图Ⅱ表示氧族元素中的氧、硫、硒、碲生成氢化物时的ΔH数据,根据ΔH数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在标准状况下,发生分解反应的热化学方程式:
________________________________________________________________________。
(3)已知:Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-25 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+19 kJ/mol ③
请写出CO还原FeO的热化学方程式:_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com