
|
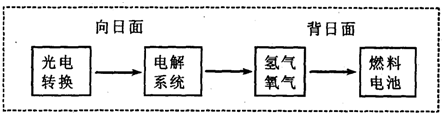
��ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOHΪ���Һ�������й�˵��������ȷ����
| |
| [����] | |
A�� |
������ת��ϵͳ�е�ˮҲ�ǿ���ѭ���� |
B�� |
ȼ�ϵ��ϵͳ����������ʵ����������ˮ |
C�� |
ˮ���ϵͳ�е�������Ӧ��4OH?/SUP>��4e?/SUP>��2H2O��O2�� |
D�� |
ȼ�ϵ�طŵ�ʱ�ĸ�����Ӧ��H2��2e?/SUP>��2OH?/SUP>��2H2O |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
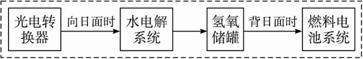
A.������ת��ϵͳ�е�ˮ����ѭ��ʹ��
B.ȼ�ϵ��ϵͳ����������ʵ����������ˮ
C.ˮ���ϵͳ�е�������Ӧ��4OH--4e-![]() 2H2O+O2��
2H2O+O2��
D.ȼ�ϵ�طŵ�ʱ�ĸ�����Ӧ��H2-2e-+2OH-![]() 2H2O
2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
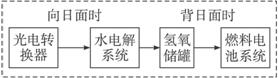
A.������ת��ϵͳ�е�ˮҲ�ǿ���ѭ����
B.ȼ�ϵ��ϵͳ����������ʵ����������ˮ
C.ˮ���ϵͳ�е�������Ӧ��4OH--4e-====2H2O+O2��
D.ȼ�ϵ�طŵ�ʱ�ĸ�����Ӧ��H2-2e-+2OH-====2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012ѧ��ɽ��ʡΫ���и߶�������ҵ��ѧ�Ծ����壩 ���ͣ������
ij����С����е�ⱥ��ʳ��ˮ��ʵ��(��ͼ)����ͬ���������⡣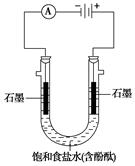
(1)ͨ��һ��ʱ��ɹ۲쵽_______________�缫(��
����������������)������Һ��ɫ�ȱ�죬�õ缫�ϵĵ�
����ӦʽΪ____________��
(2)����Һ��ⷴӦ�Ļ�ѧ����ʽΪ ��
(3)����ʼʱ���������������������ĵ缫��ӦʽΪ ___________________________________��
(4)����H2��O2Ϊ��Ӧ���KOHΪ�������Һ���ɹ�������ȼ�ϵ��(����ͼ)�������缫���ɶ����̿�Ƴɣ�ͨ��������ɿ�϶���ݳ������ڵ缫����ŵ硣����a�ǣߣߣ�(���������)��b���ĵ缫��ӦʽΪ ��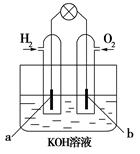
(5)��ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOHΪ���Һ�������й�˵���в���ȷ���� ������ţ�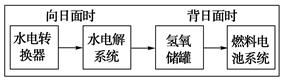
| A��������ת��ϵͳ�е�ˮҲ�ǿ���ѭ���� |
| B��ȼ�ϵ��ϵͳ����������ʵ����������ˮ |
| C��ȼ�ϵ�طŵ�ʱ��������Ӧ�� H2��2e����2OH����2H2O |
| D��ˮ���ϵͳ�е�������Ӧ��4OH���D4e����2H2O��O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�ձ����и����ڶ��ε��в��Ի�ѧ�Ծ��������棩 ���ͣ�������
�����ߡ�������д���ҹ�������ҵ����ƪ�¡����������Ҫ���ܵ�ȼ�ϣ�ͨ������(N2H4)��Ϊȼ�ϣ�N2O4����������
��1����֪��N2(g) + 2O2(g) =2NO2(g) ��H����67.7 kJ��mol��1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ��H����534.0 kJ��mol��1
2NO2(g) N2O4(g)
��H����52.7 kJ��mol��1
N2O4(g)
��H����52.7 kJ��mol��1
��д����̬������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ�� ��
��2����ҵ�Ͽ��ô�������������İ���Ӧ�Ʊ��£��÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��3��һ�������£���2L�ܱ���������ʼͶ��2 mol NH3��4 mol O2������Ӧ��
4NH3(g)+5O2(g�� 4NO(g)+6H2O(g)
��H<0
4NO(g)+6H2O(g)
��H<0
���ƽ��ʱ�������£�
|
ƽ��ʱ���ʵ�����mol�� |
n(NO) |
n(H2O�� |
|
�¶�T1 |
1.6 |
2.4 |
|
�¶�T2 |
1.2 |
1.8 |
�����¶�T1�£�������10min��Ӧ�ﵽƽ�⣬��10min�ڷ�Ӧ��ƽ������
v(NH3)�� ��
���¶�T1��T2�Ĵ�С��ϵ��T1 T2���>���� ��<����������
��4�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ���֪�÷�Ӧ��������ӦΪ�� =O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
=O2��+2H2O����������ӦΪ �����������������Ʒ�Ӧ2CO=2C+O2����H��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ����Է����в�˵������ ��
��5����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOH��ҺΪ���Һ��
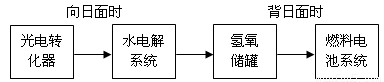
���ij��ʱ�������������й��ռ���33.6L���壨������ɱ�״��������ö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com