
����Ŀ��t��ʱ����2 mol����A��1 mol����B�����ݻ�Ϊ2 L�ĺ����ܱ������У��������·�Ӧ��2A(g) + B(g)![]() xC(g)��2 minʱ��ѧ��Ӧ�ﵽ�ȣ��¶���Ϊt�棩����ʱB���� 0. 6 mol�������C��Ũ��Ϊ0.6 mol L-1����ش��������⣺
xC(g)��2 minʱ��ѧ��Ӧ�ﵽ�ȣ��¶���Ϊt�棩����ʱB���� 0. 6 mol�������C��Ũ��Ϊ0.6 mol L-1����ش��������⣺
��1���жϸ÷�Ӧ�ﵽ�ȵı�־��_______��
a.�����е�ѹǿ���ֲ���
b. A������������B����������֮��Ϊ2��1
c.�����ڻ��������ܶȱ��ֲ���
d. A�İٷֺ������ֲ���
e. B��C�����ʵ���Ũ��֮��Ϊ1��x
��2��x=_______���ӷ�Ӧ��ʼ���ﵽ��ʱ����B��ʾ�÷�Ӧ��ƽ����Ӧ����V(B) =____________��
��3���������¶Ȳ��䣬�������������������Ӧ����___________�����������С�����䡱��
��4����ѧ��Ӧ�ﵽ��ʱ��A��ת����Ϊ______________________��
���𰸡� b��d 3 0.1 mol��L-1��min-1 ��С 40%
��������2A(g) + B(g)![]() xC(g)��
xC(g)��
��ʼ���ʵ���(mol) 2 1 0
�仯���ʵ���(mol) 0.8 0.4 0.4x
ƽ�����ʵ���(mol) 1.2 0.6 0.4x
��ƽ��ʱC��Ũ��Ϊ![]() =0.6 mol L-1�����x=3��
=0.6 mol L-1�����x=3��
(1)a����֪��Ӧ2A(g) + B(g)![]() 3C(g)�����������������ʵ���ʼ�ղ��䣬������䣬ѹǿҲʼ�ղ��䣬�����ж���ƽ��״̬����a����b��A������������B����������֮��Ϊ2��1��˵��A�����淴Ӧ������ȣ���ƽ��״̬����b��ȷ��c�������������������ʼ�ղ��䣬�����ڻ��������ܶ�ʼ�ձ��ֲ��䣬���ж���ƽ��״̬����c����d��A�İٷֺ������ֲ��䣬˵���ﵽƽ��״̬����d��ȷ��e��B��C�����ʵ���Ũ��֮��Ϊ1��3ʱ�������ж���ƽ��״̬����e����Ϊbd��
3C(g)�����������������ʵ���ʼ�ղ��䣬������䣬ѹǿҲʼ�ղ��䣬�����ж���ƽ��״̬����a����b��A������������B����������֮��Ϊ2��1��˵��A�����淴Ӧ������ȣ���ƽ��״̬����b��ȷ��c�������������������ʼ�ղ��䣬�����ڻ��������ܶ�ʼ�ձ��ֲ��䣬���ж���ƽ��״̬����c����d��A�İٷֺ������ֲ��䣬˵���ﵽƽ��״̬����d��ȷ��e��B��C�����ʵ���Ũ��֮��Ϊ1��3ʱ�������ж���ƽ��״̬����e����Ϊbd��
(2)�ɷ�����֪x=3���ӷ�Ӧ��ʼ���ﵽ��ʱ����B��ʾ�÷�Ӧ��ƽ����Ӧ����V(B) =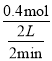 =0.1 mol��L-1��min-1��
=0.1 mol��L-1��min-1��
(3)�������¶Ȳ��䣬���������������Ӧ���������Ũ�Ⱦ���С��������Ӧ���ʼ�С��
(4)��ѧ��Ӧ�ﵽ��ʱ��A��ת����Ϊ![]() ��100%=40%��
��100%=40%��


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ�������ı������ˮϡ�����У���Һ�ĵ��������仯��ͼ��ʾ������˵����ȷ����

A��a��b��c������Һ��pH��c��a��b
B����ʪ���pH��ֽ����a����Һ��pH���������ƫС
C��a��b��c����CH3COOH�ĵ���̶ȣ�c��a��b
D��a��b��c������Һ��1 mol��L1 NaOH��Һ�кͣ�����NaOH��Һ�����c��a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������н��з�Ӧ��X2(g)+Y2(g)![]() 2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
2Z(g)����X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��״̬ʱ������˵����ȷ����
A��Z��Ũ�ȿ���Ϊ0.3mol/L
B��ƽ��ʱX2��Y2��ת�������
C��ƽ��ʱ��Y2��Z����������֮��Ϊ2:1
D����ƽ����ٸı���������������¶ȣ���Ӧ��ƽ�ⳣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����﮵��֮�������ѧ�������Ƴ��ȶ��Ը��ߡ���ѹ��ʧ��С�ġ��ơ���������ء����䷴Ӧԭ���ǣ�2Na+O2=Na2O2��װ����ͼ�����е��ҺΪNaPF6���ɴ���Na+����طŵ�ʱ������˵������ȷ����

A. a�缫Ϊ���� B. Na+��b���ƶ�
C. a������������Ӧ D. b�缫�ĵ缫��Ӧʽ��O2+2Na++4e- =Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��9�£����Ǹ���1�����й���̨��Ĭ�ƶ�����վMFC30��ʽ������MFC30�ǻ��ڼ״���������ȼ�ϵ�ط��缼����
��1���״����ⷽʽ��Ҫ���������֣���Ӧ��״�ˮ�����������⣺CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ��H1=+49.4 kJ/mol��Ӧ��״��ֽ����⣺CH3OH(g)
CO2(g)+3H2(g) ��H1=+49.4 kJ/mol��Ӧ��״��ֽ����⣺CH3OH(g)![]() CO(g)+2H2(g) ��H2=+90.6 kJ/mol��Ӧ����̬�״�������������ͬʱ���ɶ�����̼��������
CO(g)+2H2(g) ��H2=+90.6 kJ/mol��Ӧ����̬�״�������������ͬʱ���ɶ�����̼��������
����֪CO��ȼ����Ϊ283.0 kJ/mol����Ӧ����Ȼ�ѧ��Ӧ����ʽΪ____________��
�ڸ��������ⷽʽ�У������ļ״��������������Ƿ�Ӧ____________��(��������������������������
��2��ʵ����ģ�ⷴӦ��״�ˮ��������������۲죬�ϳ������n(CH3OH): n(H2O)=1��1ʱ����ϵ�м״���ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��

�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ____________________��
�ڵ��¶�Ϊ250�桢ѹǿΪP2ʱ����Ӧ��ƽ��ʱH2���������Ϊ____________��
��ͼ�е�ѹǿ��С�����˳����____________��
��3��MFC30ȼ�ϵ��������Ϊȼ�ϣ�Li2CO3��K2CO3��ϵ�̼����Ϊ����ʵĸ�����ȼ�ϵ�أ��为���ĵ缫��ӦʽΪ____________��������ͨ�������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������۷��������ᡢMgCl2��Һ��FeCl3��Һ��CuCl2��Һ��ɵĻ��Һ�У���ַ�Ӧ��������ʣ�࣬����Һ���д������������ǣ� ��
A.Cu2+��Fe2+
B.H+��Cu2+
C.Fe3+��Fe2+
D.Fe2+��Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݵ��飬���ʵļ�ͥװ�β��ϻ��ͷų��������������������к����ʣ�����һ���л�����ӵ����ģ������ͼ��ͼ�С���������������˫������������ͬ��С���������ͬԪ�ص�ԭ�ӣ�������Ԫ��λ�ڲ�ͬ�Ķ����ڡ�������ڸ��л������������ȷ����

A���л��ﻯѧʽΪC2HCl3
B������������ԭ����ͬһ��ƽ����
C�����л���������ˮ
D��������Ȳ���Ȼ���ӳɵõ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.0 gCuͶ��50mL 12moL/L��Ũ�����У���ַ�Ӧ���ռ���4.48L����״����NO��NO2�Ļ�����塣
��1������ԭ��������ʵ�����_________mol��
��2���ж�32.0gCu��50mL 12moL/L�����ᷴӦ����ʣ�����______________��ʣ����������ʵ���Ϊ____________________�����ɵ�NO�������Ϊ������£�_________________��
��3���������Ӧ�����ϵ���ټ���100mL2mol/L��ϡ���ᣬ��ַ�Ӧ�����������ݳ���д����Ӧ�����ӷ���ʽ���õ����ŷ���ʾ����ת�Ƶķ������Ŀ _______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ��е�һ���֣������г���11��Ԫ�������ڱ��е�λ�ã���Ҫ��������и�С�⡣

��1����ѧ��������õ�Ԫ����_______����Ԫ�ط��ţ���ͬ�����ǽ�������ǿ��Ԫ����______����������ǿ�ĵ�����ˮ��Ӧ�����ӷ���ʽ��____________________��
��2���٢ۢ�����Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ��______��
��3���٢ڢ�����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����____>____>____��
��4��ijԪ�ص�����������Ӧ��ˮ����������ᷴӦ�����κ�ˮ�����ܺͼӦ�����κ�ˮ����Ԫ��Ϊ________�������������и�Ԫ�صĻ��ϼ�Ϊ______����Ԫ�ص��������������ᷴӦ�����ӷ���ʽΪ___________�����Ԫ�غ͢��Ԫ���γɵĻ��������Һ�У������μ�����������Һ��������������ʵ��������____________���йط�Ӧ�Ļ�ѧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com