
 (1)电解池中与外电源负极相连的电极反应式为
(1)电解池中与外电源负极相连的电极反应式为

科目:高中化学 来源: 题型:
| A、着色剂_______苯甲酸钠 |
| B、调味剂_______亚硝酸钠 |
| C、营养强化剂_______酱油中加铁 |
| D、防腐剂_______胡萝卜素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中 |
| B、常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中 |
| C、与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| D、常温下,铝在浓硝酸中钝化而铜不发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、异戊二烯[CH2═C(CH3)CH═CH2]与等物质的量的Br2发生加成反应 |
| B、1-丁烯(CH3CH2CH═CH2)与HC1分子发生的加成反应 |
| C、2-丁炔(CH3C≡CCH3)与等物质的量Cl2发生的加成反应 |
D、苯甲酸( )与NaHCO3溶液反应 )与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
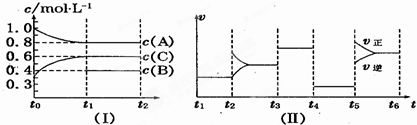
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1醋酸溶液所得滴定曲线如图.分析图中的①、②、③点,完成下列闯题:
常温下,用0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1醋酸溶液所得滴定曲线如图.分析图中的①、②、③点,完成下列闯题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |

| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com