
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
分析 酸或碱抑制水电离,含有弱离子的盐或升高温度都促进水电离,且最终所得溶液呈酸性,则改变条件应该是加入强酸弱碱盐,据此分析解答.
解答 解:A.将水加热到100℃时,水的pH=6,但溶液中仍然存在c(H+)=c(OH-),溶液仍然呈中性,故A错误;
B.硫酸电离出氢离子而抑制水电离,故B错误;
C.NaHCO3中碳酸氢根离子水解程度大于电离程度导致水溶液呈碱性,故C错误;
D.硫酸铜是强酸弱碱盐,铜离子水解导致溶液呈酸性,且促进水电离,故D正确;
故选D.
点评 本题以盐类水解为载体考查水的电离,为高频考点,明确影响水电离因素是解本题关键,易错选项是A,注意:溶液酸碱性要根据c(H+)、c(OH-)判断,温度未知时不能根据溶液pH判断溶液酸碱性,为易错点.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) | |
| D. | 12g碳所含的原子数就是阿伏加德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;试用电子式表示原子个数比为2:1的该化合物的形成过程
;试用电子式表示原子个数比为2:1的该化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 粒子数(个) | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| 氦气 | 0.3 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H22O11 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
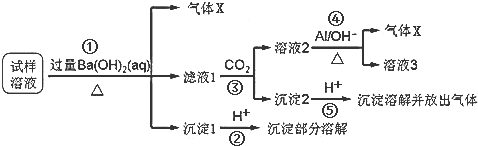
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com