
【题目】在下列叙述中,正确的是( )
A.氧气的摩尔质量是32
B.2molNaCl固体溶解于1L水所得溶液的物质的量浓度为2mol/L
C.标准状况下同体积的O2和O3中所含分子数相等
D.在标准状况下,体积为22.4L的物质都是1mol
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A. 加入10mL 0.08mol·L-1的NaOH溶液 B. 加入100mL 的水进行稀释
C. 加水稀释成1L D. 加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
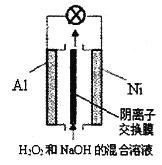
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是

A. “溶解”操作中溶液温度不宜过高
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C. 与锌粉反应的离子可能为Cu2+、H+
D. “过滤”操作后,将滤液蒸发结晶、过滤、洗涤、干燥后,高温灼烧即可得纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
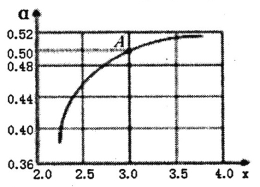
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
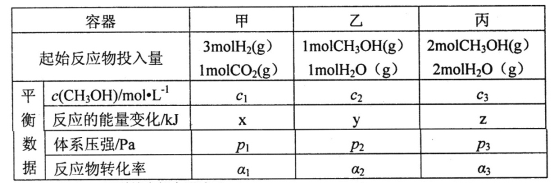
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。提示:图中A代表沉淀或者溶液

(1)检验提纯后的KCl中是否还含有SO42-的方法是____________________________。
(2)用提纯后的KCl配制980 mL 1.00 mol/L的氯化钾溶液,回答下列问题:
①根据计算,所需称量的KCl的质量为__________。
②容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的______。(填数字符号)
③下列操作会使所配溶液浓度偏低的是__________(填选项代号)。
A.配制前容量瓶内壁刻度线以下存有水珠 B.没有洗涤烧杯内壁
C.转移溶液时部分溶液溅出容量瓶外 D.定容时俯视
(3)试剂Ⅰ的名称为______,试剂Ⅱ的化学式为______,试剂Ⅲ的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3,下列判断正确的( )
2SO3,下列判断正确的( )
A. 标准状况下,2L SO2和足量O2反应最终生成2L SO3
B. 平衡时,再向容器中通入O2,可使SO2的转化率达到100%
C. 平衡时,SO2的消耗速率必定等于O2生成速率的二倍
D. 平衡时,SO2的浓度必定等于O2浓度的二倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com