
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的化学反应方程式_____________________________
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O=Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目___________________________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
下列图像是NaCl、CsCl、ZnS等离子晶体结构图或是从其中分割出来的部分结构图。试判断属于NaCl的晶体结构的图像为 ( )
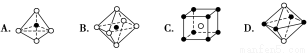
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:选择题
以下说法正确的是
A.埃博拉病毒对化学药品敏感,乙醇可以将病毒氧化而达到消毒的目的
B.气象环境报告中新增的“PM2.5”是对一种新分子的描述
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用效果更好
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期第四次调研化学试卷(解析版) 题型:选择题
甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含有18个电子。甲是气态氢化物。在水中分步电离出两种阴离子。下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素
C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成
D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上第二次月考理综化学试卷(解析版) 题型:选择题
下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的的是
A.用装置甲制取氨气
B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性
D.用装置丁吸收尾气
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
选项 | 操作及现象 | 溶液 |
A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二上10月月考化学卷(解析版) 题型:选择题
298K时,在容积不变的密闭容器中注满NO2气体,2NO2(g)?N2O4(g)△H<0.平衡后把该容器置于沸水中,下列性质或数值不会改变的是( )
①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度.
A.①② B.②③ C.④⑤ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应达平衡后,若压缩容器的体积,则SiCl4的转化率增大
B.若反应开始时投入1mol SiCl4、2mol H2,则达到平衡时吸收热量为Q kJ
C.若反应4min HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol·(L·min) -1
D.当反应吸收热量为0.025 Q kJ时,则生成的HCl全部通入100mL1mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com