


分析 海水淡化得到氯化钠,电极氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到韩HBr和的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
(1)根据淡化海水的方法分析,根据目前淡化海水的方法有:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法;
(2)步骤Ⅰ是氯气氧化溴离子生成溴单质的反应;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)除去氯气时注意不能影响溴的性质,更不能引入新杂质;
(5)①蒸馏时,为充分冷凝,冷凝水应从下端进,上端出;
②溴单质颜色为红棕色易挥发,常温下为液体;
③进入D装置的物质为溴蒸汽,溴蒸汽有毒,可用氢氧化钠除溴单质.
解答 解:(1)目前淡化海水的方法有多种,如:蒸留法、电渗透法、离子交换法、水合物法、溶剂萃取法和冰冻法;
故答案为:蒸留法或电渗透法或离子交换法等;
(2)步骤Ⅰ是氯气氧化溴离子生成溴单质的反应,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)题中KI与氯气、溴单质发生氧化还原反应,不能除杂,NaBr可与氯气反应,可将杂质除去,且不引入新的杂质,而Na2CO3溶液、Na2SO3溶液与溴、氯气都反应,不能用于除杂,
故答案为:c;
(5)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,冷凝水应从下端进,
故答案为:冷凝管;
②在C中烧杯里加冰的作用是为冷凝生成的溴单质为液体分离,
故答案为:降温冷凝溴单质;
③进入D装置的物质为溴蒸汽,溴蒸汽有毒,避免污染环境,最后进行尾气吸收,D中用NaOH浓溶液的作用是吸收尾气,
故答案为:吸收尾气.
点评 本题考查物质的分离、提纯,侧重海水资源的综合利用、海水提溴工艺等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取溴的原理为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-Χ}{7}$ | C. | $\frac{3Χ}{4}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
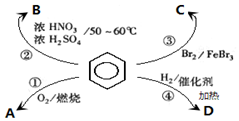
| A. | 反应①为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| B. | 反应②为取代反应,有机产物B是一种芳香烃 | |
| C. | 反应③为取代反应,产物溴苯是比水重的无色液体 | |
| D. | 反应④为加成反应,若H2足量则产物D为环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “一碳化学”的重要反应CO(g)+2H2(g)?CH3OH(g)的过程能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
“一碳化学”的重要反应CO(g)+2H2(g)?CH3OH(g)的过程能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 曲线I的反应热比曲线II高 | |
| B. | 曲线I的反应速率比曲线II快 | |
| C. | 该反应的活化能为+91 kJ•mol-1 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ | |
| B. | Y的起始浓度不能为零,平衡浓度也不能为零 | |
| C. | 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动 | |
| D. | 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝和氧化铁在高温下反应制取铁 | B. | 用溴和碘化钾溶液反应制取碘 | ||
| C. | 用碳和高温水蒸汽反应制取氢气 | D. | 用氢气和灼热的氧化铜反应制取铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com