
解析:在SO3·nH2O或H2SO4·nH2O表示式中,n(SO3)∶n(H2O)=1∶n,n(H2SO4)∶n(H2O)=1∶n均为物质的量之比。
因此本题须将有关浓度转化成物质的量,再根据元素守恒计算。
98% H2SO4中:m(H2SO4)∶m(H2O)=98∶2
则物质的量之比为:
![]()
而H2SO4中SO3与H2O物质的量之比为?1∶1。
所以98% H2SO4可写成:SO3·![]() H2O或H2SO4·
H2O或H2SO4·![]() H2O。
H2O。
用w g 98% H2SO4吸收SO3,生成H2SO4·SO3,再用水稀释成98% H2SO4,整个过程用守恒法计算:
w g[H2SO4·![]() H2O]
H2O]![]() (1+
(1+![]() )[H2SO4·SO3]
)[H2SO4·SO3]![]() 2(1+
2(1+![]() )[H2SO4·
)[H2SO4·![]() H2O]
H2O]
列关系式:
![]()
1 ![]()
w x
![]()
答案:H2SO4·![]() H2O SO3·
H2O SO3·![]() H2O
H2O ![]() w g
w g


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市东城区高三下学期零模诊断理综化学试卷(解析版) 题型:填空题
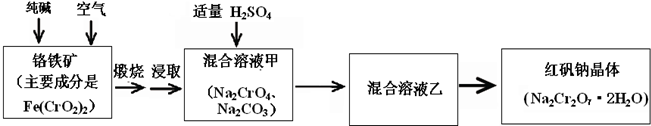
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
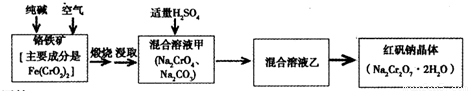
请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
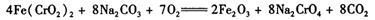
为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:

①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。
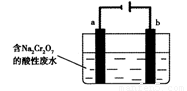
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com