
| A. | 11.2 LNH3所含分子数为0.5NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 23g金属钠与氧气加热生成Na2O2的反应,转移的电子数为2NA | |
| D. | 5.6g铁与足量的盐酸反应,失去的电子数为0.2NA |
分析 A、氨气所处的状态不明确;
B、氯气和铁反应后变为-1价;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、求出铁的物质的量,然后根据铁和盐酸反应后变为+2价来分析.
解答 解:A、氨气所处的状态不明确,故其物质的量无法计算,故分子个数无法计算,故A错误;
B、氯气和铁反应后变为-1价,故1mol氯气转移2NA个电子,故B错误;
C、23g钠的物质的量为1mol,而钠反应后变为+1价,故1mol钠反应转移NA个电子,故C错误;
D、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故0.1mol铁失去0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 向KNO3溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀NaCl溶液中滴加稀HNO3 | D. | 向NaCl溶液中滴加Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
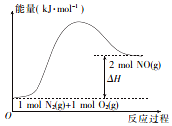 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( )| A. | 该反应是放热反应 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应过程中有共价键的断裂和形成 | |
| D. | 使用催化剂可以改变反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N、Q三种物质的浓度一定相等 | B. | 反应物和生成物的浓度都保持不变 | ||
| C. | M、N全部变成了Q | D. | 反应已经停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
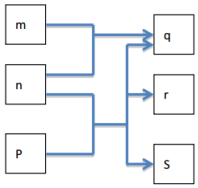 短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂.
短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,E
,E .
. ;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥
;②CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O;⑥ .H→I
.H→I $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ | |
| B. | Cl-的结构示意图: | |
| C. | 乙醇的结构式:C2H5OH | |
| D. | HOCH2COOH缩聚产物的结构简式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com