
下列离子 组在一定条件下能共存
组在一定条件下能共存 ,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂 | 加入试剂后发 |
| A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=== Fe(OH)3↓ |
| C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
| D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3OH-=== Al(OH)3↓ |
科目:高中化学 来源: 题型:
溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO ,其离子方程式为__________________________________________。
,其离子方程式为__________________________________________。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,________显正电性。BrCl与水发生反应的化学方程式为____________________________________________。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)===2CuBr(s)+ Br2(g)
ΔH=+105.4 kJ/mol
在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103 Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会________(填“增大”“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
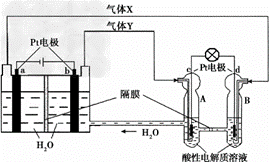
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,有关说法正确的是
A.当有0.1 mol电子转移时,a极产生 0.56 L O2(标准状况下)
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.d极上发生的电极反应是:O2 + 4H+ + 4e- 2H2O
D.c极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72−和CrO42−,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72−的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是_______________________________。
(2)阴极附近溶液pH升高的原因是_______________________________(用电极反应式解释);溶液中同时生成的沉淀还有________________。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:
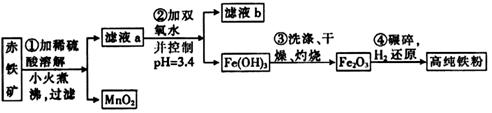
已知:①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(3)步骤②中加双氧水的目的是_________________________,pH控制在3.4的作用是_____________________________;已知25℃时,Ksp[Cu(OH)2]=2.0×10-20,该温度下反应:Cu2++2H2O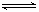 Cu(OH)2+2H+的平衡常数K=_______________。
Cu(OH)2+2H+的平衡常数K=_______________。
(4)制备氮化铁的反应:Fe+NH3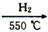 FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
FexNy+H2(未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E均是由下列离子组成的可溶性化合物。组成这五种物质的离子有(离子不能重复组合):
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO |
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生。继续加入B溶液,沉淀全部消失。
③将E溶液加热,有沉淀生成。
据此推断:A________;B________;C________;
D________;E_____ ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.铝片与NaOH溶液反应:Al+2OH-===AlO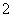 +H2↑
+H2↑
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+===Fe2++CO2↑+H2O
C.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO +CO2+H2O===2NaHCO3↓
+CO2+H2O===2NaHCO3↓
 D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO
D.Ba(OH)2与过量的NH4HSO4反应:Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )
| A | CH3CH3+Cl2 CH2===CH2+HCl―→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-===2Cl-+Br2 Zn+Cu2+===Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O===4NaOH+O2↑ Cl2+H2O===HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与H2发生加成反应
C.能发生银镜反应
D.在浓H2SO4催化下能与乙酸发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com