
| X | Y | |
| Z | W |
| A、气态氢化物的稳定性:Y>Z |
| B、气态氢化物的沸点:Y<W |
| C、元素原子半径大小:X>Y |
| D、简单离子的半径:Z>W |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:阅读理解
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 | A | B | C | D | E | F |
|
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B、D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。
a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
查看答案和解析>>
科目:高中化学 来源:2010年甘肃省部分普通高中高三第二次联合考试(理综)化学部分 题型:填空题
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 | A | B | C | D | E | F |
| 性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |

查看答案和解析>>
科目:高中化学 来源:2010年甘肃省高三第二次联合考试(理综)化学部分 题型:填空题
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
|
元素 |
A |
B |
C |
D |
E |
F |
|
性质或结构 信息 |
形成化合物种类最多的元素 |
最高正价是最低负价绝对值的3倍 |
族序数等于周期数的3倍 |
周期数是族序数的3倍 |
地壳中含量最高的金属元素 |
最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B、D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。

a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是依各个原子的性质和原子序数(1-20)作的关系图,各图的纵轴可能代表下列的某一个性质:质量数、质子数、中子数、最高正价、原子半径大小、得电子相对能力。而图1~图4所对应的纵轴数值全部是整数,图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值,所以图3中8、9和图4中1和3、9和11、17和19之间以虚线连结。
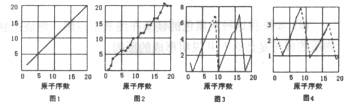
(1)图1一图4的纵轴数值分别代表________、_______、____________、___________。
(2)其中已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,⑨(c+e)/2=d,请根据提供的信息,

回答下列问题:
①右图是元素周期表前三周期的边界,请将A―G六种具体元素符号填在表中相应的位置。
②写出铜与上述某一元素最高价氧化物对应的水化物反应的化学方程式(任写一个)
____________________________________________________________________
③写出上述元素形成的物质之间能够发生置换反应的化学方程式(任写一个)
_____________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com