
| A. | 30 | B. | 20 | C. | 12 | D. | 17 |
科目:高中化学 来源: 题型:选择题
| A. | 量取10.08 mL 0.1 mol•L-1 NaHCO3溶液用碱式滴定管量取 | |
| B. | 为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对 H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知 4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1 KI 溶液、0.1 mol•L-1 稀硫酸外,还需要用到淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | X、Y分别与W形成的化合物都具有两性 | |
| B. | Z、W在同一主族 | |
| C. | 气态氢化物的稳定性为H2W<H2Z | |
| D. | X和Y对应的氢氧化物的碱性强弱比较:X(OH)2<Y(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 全对 | B. | 全错 | C. | ③④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1 | |
| C. | pH=9的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>③>② | |
| D. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH HCl>CH3COOH | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,消耗的NaOH溶液体积一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl、KNO3、AlCl3、Fe(NO3)3 | B. | Fe、FeO、CuO、FeS、CuS、MnO2 | ||
| C. | MgCl2、FeCl2、KCl、AlCl3、NH4Cl | D. | K2CO3、NaI、Na2CO3、NaCl、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. | 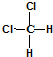 和 和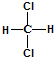 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com