
����Ŀ��ˮ�����л�������нϸߵĻ�ѧ����������������KMnO4�����л�����京������Ҫ�����������£� 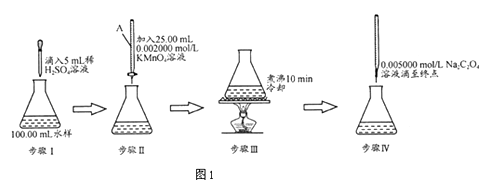
��1������AΪ������ʽ���ʽ���ζ��ܣ�Ҫ˳�����ʵ�飬���������Һ��ɫӦΪ��
��2�����Ʋ�����漰�����ӷ���ʽ��
C2O42��+MnO4��+H+�TMn2++CO2��+��
�ò����е����һ��Na2C2O4ʱ��ɫ�������Ժ�ĵζ�����ɫ�Ͽ죬��ԭ����
��3���������������Na2C2O4��ҺΪ20.00mL����֪�ζ����Һ����ͼ��ʾ������ͼ2�б���ζ�ǰ��Һ�森 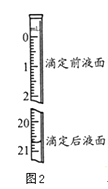
��4����ʵ����������ʵ���л��ﺬ��ƫ�ߣ��ֱ����������������룺
����1��ˮ����Cl��Ӱ��
����2������Na2C2O4��Һ����ʱ��
��5��������1��������������Ͽ�Ƭ������������ʵ��������Cl��Ӱ�죮����ѡ�Լ���AgNO3��Һ��Ag2SO4��Һ��KMnO4��Һ��Na2C2O4��Һ�� ��
���Ͽ�Ƭ��
���л��ʿ�HNO3������
��AgCl��������KMnO4��Һ��Ӧ
��Ag2C2O4�ɱ�����KMnO4��Һ������
���𰸡�
��1����ʽ���Ϻ�ɫ
��2��5��2��16��2��10��8H2O���淴Ӧ����Mn2+��������Ӧ�Ĵ���
��3��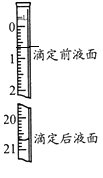
��4�����ӿ̶���
��5��������ˮ���м���������Ag2SO4��Һ
�������� �⣺��1������AΪ�����������ĵζ���Ϊ��ʽ�ζ��ܸ��������Һ�ζ������һ����Һ���Ϻ�ɫ�Ұ���Ӳ���˵����Ӧ�ﵽ�յ㣬��Һ���Ϻ�ɫ�����������Һ��ɫӦΪ�Ϻ�ɫ�����Դ��ǣ���ʽ���Ϻ�ɫ����2��̼Ԫ�ػ��ϼ�+3�۱仯Ϊ+4�ۣ���������ԭ������Ԫ�ػ��ϼ�+7�۱仯Ϊ+2�ۣ�C2O42��ǰ��ϵ��5��MnO4��ǰϵ����2�������غ㡢����غ㡢ԭ���غ���ƽд�����ӷ���ʽΪ��5C2O42��+2MnO4��+16H+=2Mn2++10CO2��+8H2O���ò����е����һ��Na2C2O4ʱ��ɫ�������Ժ�ĵζ�����ɫ�Ͽ죬˵����Ӧ�����ɵ������ӶԷ�Ӧ���������ã����Դ��ǣ�5��2��16��2��10��8H2O���淴Ӧ����Mn2+��������Ӧ�Ĵ����� Na2C2O4��ҺΪ20.00mL����ζ��ܶ���Ϊ��  ���Դ��ǣ�
���Դ��ǣ�  ����4��ʵ����������ʵ���л��ﺬ��ƫ�ߣ�����Na2C2O4��Һ����ʱ�������Ƕ�ȡ����ʱ�ѵζ�����������Һ��������ˣ�
����4��ʵ����������ʵ���л��ﺬ��ƫ�ߣ�����Na2C2O4��Һ����ʱ�������Ƕ�ȡ����ʱ�ѵζ�����������Һ��������ˣ�
���Դ��ǣ����ӿ̶��ߣ���5�����л��ʿ�HNO3����������AgCl��������KMnO4��Һ��Ӧ����Ag2C2O4�ɱ�����KMnO4��Һ������ AgNO3��Һ��������Һ���γ�ϡ������������ԣ��ʲ����ϣ� Ag2SO4��Һ���������������Ȼ����ܽ��С����ת��������������Ӱ�죻 KMnO4��Һ���������ԣ���������Ӱ�죻 Na2C2O4��Һ���Ա����������Һ��������������������Cl��Ӱ���ڲ�����ˮ���м���������Ag2SO4��Һ�����Դ��ǣ�������ˮ���м���������Ag2SO4��Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����������������
A. 0.5mol/LCuCl2��Һ�к��е�Cl-��ĿΪNA
B. 42gC2H4��C4H8�Ļ�����к�����ԭ����Ϊ6NA
C. ��״����,H2��CO�������4.48L������O2�г��ȼ������O2������Ϊ0.1NA
D. �ڷ�Ӧ4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O�У�����1molCl2ʱת�Ƶĵ�������Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ����( )
A.�����ڿ�����ȼ��
B.�������������������ֽ�
C.Ba(OH)2��8H2O��NH4Cl��Ӧ
D.п����ϡH2SO4��Ӧ��ȡH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʰ��ᡢ��η������У���ȷ����(����)
A. ���� ���� ����� B. ���� �ռ� ��������
C. ̼�� �Ҵ� �ռ� D. ���� ��ʯ�� ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ײ�����������ֱ��Ϊ1nm��100nm�IJ��ϣ�����̼�������е�һ�֡�ij�о���������̼���ȵķ�ɢ������ˮ�У��õ������ʣ�������Һ ���ǽ��� �����ж�������� ����������Ĥ ����������ֽ����ֹ�����ֺ�ɫ������������ȷ����
A. �٢ܢ� B. �ڢۢ� C. �ڢۢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӷ���ʽH�� + OH��= H2O�ɱ�ʾ�Ļ�ѧ����ʽ�ǣ� ��
A. ������������ͭ�ķ�Ӧ B. �����������������Ƶķ�Ӧ
C. ������������þ�ķ�Ӧ D. �����백ˮ�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
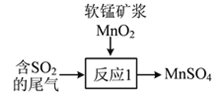
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������������ɫ��չ����̬������Ϊ�й�չʾ�������һ��������Ƭ����
��1�����Ṥҵ�ų���β������Ҫ��SO2���ж��ִ�����ʽ��
��д���ù�����ˮ����β�������ӷ���ʽ��___________________��
��β��Ҳ�������̿�MnO2�����գ�д����ͼ��ʾ����Ӧ1���Ļ�ѧ����ʽ��___________________��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___________________��
��3��ij�������ۺϴ�����NH��ˮ��ҵ��������Ҫ��N2��Cl2��NO����������������̣�

������Ӧ1����������Cl2������Ӧ1���Ļ�ѧ����ʽΪ___________________��
�� ����Ӧ2�������ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ���ʵ����������ʵ�����
B. Ħ���ǹ��ʵ�λ�����߸�������λ֮һ
C. Ħ���������ʵ����ĵ�λ���������ӵ�������λ
D. �����ӵ���������6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤����������һ���������ʵ�ǣ� ��
A.������ȶ����ֽ�
B.������ƿ���CO2��H2O��Ӧ
C.��������һ��ǿ������
D.��������Ư����ɫֽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com