
【题目】某混合物浆液含少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。已知:阴极池中得到NaOH和H2,阳极池中得到含有Cr2O72-和CrO42-的混合溶液。

(1)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是____________________。
(2)离子交换膜I属于________________(填“阳膜”或“阴膜”),阳极的电极反应方程式为___。生成Cr2O72-的原因____________(离子反应方程式和必要的文字解释)。
【答案】 在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液 阳膜 4OH--4e-=2H2O+O2↑(或2H2O-4e-= O2 ↑+ 4H+) OH-放电后,阳极池酸度增强,发生反应2CrO42-+2H+= Cr2O72-+H2O
【解析】试题分析:本题考查电解原理应用于物质的分离。
(1)在电解池中阳离子向阴极移动,阴离子向阳极移动,用惰性电极电解时,在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液而从浆液中分离出来,从而在阳极池中得到含有Cr2O72-和CrO42-的混合溶液。
(2)根据离子的放电顺序,阴极的电极反应式为:2H++2e-=H2↑,阴极附近水电离的H+浓度减小,水的电离平衡正向移动,H+继续在阴极放电,阴极附近c(OH-)![]() c(H+),阴极池中得到NaOH和H2,则离子交换膜I属于阳膜。阳极的电极反应式为:4OH--4e-=O2↑+2H2O,阳极附近水电离的OH-浓度减小,水的电离平衡正向移动,OH-继续在阳极放电,阳极附近c(H+)
c(H+),阴极池中得到NaOH和H2,则离子交换膜I属于阳膜。阳极的电极反应式为:4OH--4e-=O2↑+2H2O,阳极附近水电离的OH-浓度减小,水的电离平衡正向移动,OH-继续在阳极放电,阳极附近c(H+)![]() c(OH-),阳极池酸度增强,发生反应2CrO42-+2H+=Cr2O72-+H2O,CrO42-转化为Cr2O72-。
c(OH-),阳极池酸度增强,发生反应2CrO42-+2H+=Cr2O72-+H2O,CrO42-转化为Cr2O72-。


科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
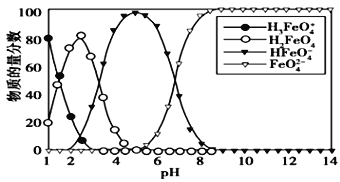
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在复习元素化合物的性质时,做了如下学习笔记,请你一起完成。
(1)氯气的颜色为__________;由氯的原子结构示意图推测,氯气具有很强的______ 性。为了证明推测是否正确,进行如下实验:
I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是___________。
II:在空气中点燃H2,然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生______色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测_____(填“正确”或“不正确”);理由是_____。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常见物质之间的转化关系。A是一种红色金属,F为不溶于酸的白色沉淀,B和C是两种强酸。(图中部分产物及反应条件略去)
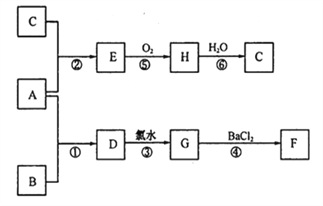
则:①A和B 分别为:A_________ B_________;
②A与B发生反应的条件是__________________;
③反应⑥的化学方程式为_____________________;
④上述反应中,不属于氧化还原反应的是_______________。(填数字序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是
![]()
A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症,在水中极易溶解,溶于乙醇和丙酮。制备溴化钙晶体(CaBr2·2H2O)的主要流程如下:

(1)检验FeBr2中是否含有Fe3+,应选择________(填字母编号)。
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制温度在40℃,不能过高和过低的原因是_____________________。
(3)要实现Fe粉至FeBr2的转化,在原料配比时应注意_____________,试剂X的化学式为_______________。
(4)加入熟石灰至出渣的过程中,固体的颜色发生变化,原因是___________(用化学反应方程式表示。)
(5)操作④的步骤为蒸发浓缩、__________、过滤、洗涤、干燥。蒸发浓缩时除酒精灯、三脚架外还需用到仪器有____________。
(6)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色无味气体,写出反应的化学方程式_____________。
(7)将上述流程中的出渣,经净化分离得到铁粉。已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 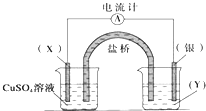
(1)电极X的材料是 , 电解质溶液Y是;
(2)银电极为电池的极,发生的电极反应为X电极上发生的电极反应为 .
(3)外电路中的电子是从电极流向电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
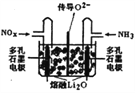
【题目】降低发动机中柴油燃烧产生NOx的排放,可利用尿素分解产生的气体采用选择性催化还原技术或储存还原技术来消除污染。
(1)选择性催化还原技术工作原理为:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式_________。
②用2Kg尿素能处理标准状况下含NOx(以NO2计)体积分数为7%的尾气10m3,则该尿素的利用率为_____________。
③将上述尾气处理原理设计成原电池,在处理了废气的同时产生电能,其工作原理如图所示。则通入NH3的一极为_______________极,通入NOx时发生的电极反应方程式为___________。
(2)储存还原技术工作原理为:NOx的储存和还原在不同时段交替进行,如图所示。
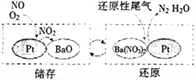
①写出上图中储存NO时发生的反应总方程式________________________。
②还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是(15N2N)2O3。将该反应的化学方程式补充完整:________![]() 口(15N2N)2O3+口H2O
口(15N2N)2O3+口H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其用途相符合的是
①Cl2——做消毒剂 ②AgBr——制胶卷,感光纸 ③AgI——人工降雨
④加碘食盐——预防甲状腺肿大 ⑤淀粉——检验I2的存在 ⑥NaClO——漂白纺织物
A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应的说法中正确的是( )
A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂
B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1
C. 反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成3molCl2,转移电子6mol
D. Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com