
| A. | 0.1 mol•L-1NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+ | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
分析 A.四种离子之间不反应,都不与氢氧化钠溶液反应;
B.该溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应;
C.铁离子与碘离子、硫氰根离子反应;
D.该溶液中存在大量氢离子,次氯酸根离子与氢离子反应.
解答 解:A.K+、Na+、SO42-、CO32-之间不反应,都不与NaOH反应,在溶液中能够大量共存,故A正确;
B.能与铝反应放出氢气的溶液呈酸性或强碱性,NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.Fe3+与I-、SCN-反应,在溶液中不能大量共存,故C错误;
D.c(H+)/c(OH-)=1×1014的溶液中存在大量氢离子,ClO-与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式 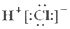 | B. | Cl-的结构示意图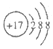 | ||
| C. | CO2的电子式 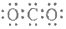 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 结论 |
| A | 相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体 | 产生氢气的速率和体积:甲>乙 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,将等质量的大理石块和大理石粉分别加入到等体积、等浓度的盐酸中 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL0.1mol•L-1Na2S溶液中滴入几滴0.1mol•L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1mol•L-1CuSO4溶液,又产生黑色沉淀 | 溶度积:KSP(ZnS)>KSP(CuS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
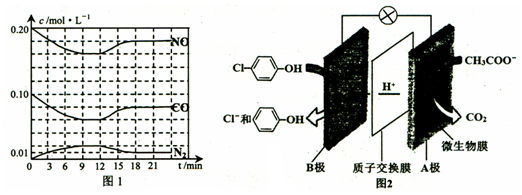
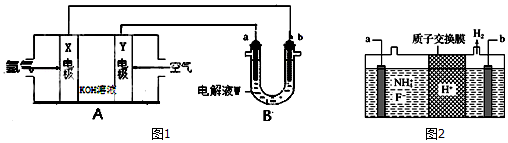
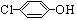 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
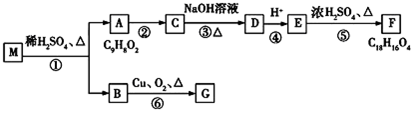
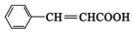 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或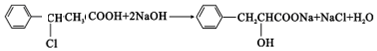 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.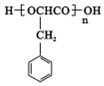 或
或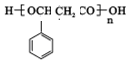 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com