
【题目】下列各组物质中,均能使Fe2O3还原成单质铁的是( )
A.CO、O2、H2B.CO、CO2、C
C.CO2、H2O、O2D.Al、C、H2
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验中,没有颜色变化的是
A.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热
B.淀粉溶液中加入碘酒
C.鸡蛋清中加入浓硝酸
D.淀粉溶液中加入稀硫酸并加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些气体具有的特征:a.有刺激性气味;b.可与水反应使溶液呈酸性;c.能使淀粉碘化钾溶液变蓝。下列各气体均符合以上全部特征的是( )
A.NO2、SO2B.NH3、NO2C.NO2、Cl2D.Cl2、SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C≡O | H﹣O | C﹣H |
E/( kJmol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=______。已知ΔH2=﹣58 kJmol-1,则ΔH3=______。
(2)合成气中的氢气是发展中的新能源,它的利用包括制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是__________________________________________________________(写出两点),缺点是______________________________________________________________________(写出两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
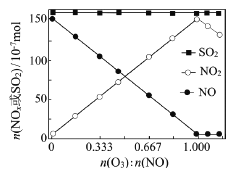
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是( )
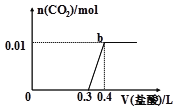
A. 原溶液中溶质为Na2CO3和NaHCO3
B. 原溶液中溶质为NaOH和Na2CO3
C. 原溶液中溶质为Na2CO3
D. 原溶液中溶质为NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com