
标准状况下,a L Cl2通入到1 L b mol/L的FeI2溶液中,充分反应后,所得溶液中Fe2+的物质的量浓度与a、b的关系如下表,请完成其余空格。
a、b的关系 | Fe2+的物质的量浓度(mol/L) |
a≤22.4b | ① b |
②a≥33.6b | 0 |
22.4b≤a≤33.6b | ③ |
【解析】根据微粒的还原性的相对强弱顺序:I->Fe2+>Br-,所以Cl2通入溶液中,①首先是将I-氧化成I2,②剩余的Cl2才可能将Fe2+氧化成Fe3+,即:
①FeI2+Cl2 FeCl2+I2
FeCl2+I2
②2FeCl2+Cl2 2FeCl3
2FeCl3
总反应为:2FeI2+3Cl2 2FeCl3+2I2
2FeCl3+2I2
从以上反应方程式不难看出:
当n(Cl2)≤n(FeI2)时,只有I-被氧化,Fe2+的浓度保持不变;
当n(Cl2)>n(FeI2)时,I-全被氧化,Fe2+部分或全部被氧化。
故Fe2+的浓度有如下三种情况:
(1)![]() ≤b mol,a≤22.4b c(Fe2+)=b mol/L
≤b mol,a≤22.4b c(Fe2+)=b mol/L
(2)![]() :b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
:b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
(3)22.4b≤a≤33.6b,Fe2+部分氧化c(Fe2+)=b-(![]() -b)×2 mol/L
-b)×2 mol/L
【解析】 根据微粒的还原性的相对强弱顺序:I->Fe2+>Br-,所以Cl2通入溶液中,①首先是将I-氧化成I2,②剩余的Cl2才可能将Fe2+氧化成Fe3+,即:
①FeI2+Cl2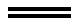 FeCl2+I2
FeCl2+I2
②2FeCl2+Cl2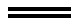 2FeCl3
2FeCl3
总反应为:2FeI2+3Cl2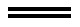 2FeCl3+2I2
2FeCl3+2I2
从以上反应方程式不难看出:
当n(Cl2)≤n(FeI2)时,只有I-被氧化,Fe2+的浓度保持不变;
当n(Cl2)>n(FeI2)时,I-全被氧化,Fe2+部分或全部被氧化。
故Fe2+的浓度有如下三种情况:
(1)![]() ≤b mol,a≤22.4b c(Fe2+)=b mol/L
≤b mol,a≤22.4b c(Fe2+)=b mol/L
(2)![]() :b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
:b mol≥3∶2,a≥33.6b时,Fe2+全部被氧化,c(Fe2+)=0
(3)22.4b≤a≤33.6b,Fe2+部分氧化c(Fe2+)=b-(![]() -b)×2 mol/L
-b)×2 mol/L


科目:高中化学 来源: 题型:
| a |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 11.2 |
| a |
| 11.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com