
| A、升高温度 |
| B、增加压强 |
| C、减小SO3的浓度 |
| D、使用催化剂 |


科目:高中化学 来源: 题型:
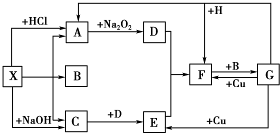 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
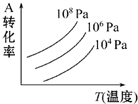 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )| A、正反应是放热反应;m+n<p+q |
| B、正反应是吸热反应;m+n<p+q |
| C、正反应是放热反应;m+n>p+q |
| D、正反应是吸热反应;m+n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.
某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、2Q1>O2 | ||
| B、Q1>2Q2 | ||
| C、2Q1<Q2 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
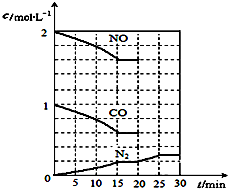 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com