
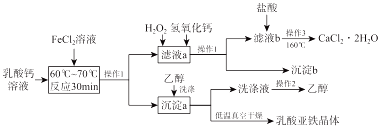
分析 流程中向乳酸钙溶液中加入过量的FeCl2溶液在60℃-70℃反应30min生成[CH3CH(OH)COO]2Fe•3H2O沉淀和CaCl2溶液,过滤得到沉淀a为[CH3CH(OH)COO]2Fe•3H2O,滤液a为CaCl2和过量的FeCl2溶液,向其中加入双氧水,将二价铁氧化成三价铁离子,再加入氢氧化钙溶液使铁离子形成氢氧化铁沉淀而除去,所以再过滤得到沉淀b为氢氧化铁沉淀,滤液b为CaCl2和过量的氢氧化钙溶液,加盐酸除去过量的氢氧化钙,在蒸发浓缩、冷却结晶得到二水合氯化钙晶体;沉淀a为[CH3CH(OH)COO]2Fe•3H2O用乙醇洗涤后,洗涤液为含乙醇的溶液,通过蒸馏又回收乙醇,[CH3CH(OH)COO]2Fe•3H2O沉淀低温真空干燥得到乳酸亚铁晶体,据此分析解答.
解答 解:(1)因为铁与氯化铁反应制备氯化亚铁时原子利用率为100%,所以氯化铁和铁发生化合反应生成氯化亚铁,方程式:Fe+2FeCl3=3FeCl2;又因为FeCl2溶液易被氧化,所以在FeCl2溶液中需要加铁粉放氧化,故答案为:Fe+2FeCl3=3FeCl2;铁粉;
(2)向乳酸钙溶液中加入过量的FeCl2溶液在60℃-70℃反应30min生成[CH3CH(OH)COO]2Fe•3H2O沉淀和CaCl2溶液,方程式为:[CH3CH(OH)COO]2Ca+FeCl2+3H2O$\frac{\underline{\;60-70℃\;}}{\;}$[CH3CH(OH)COO]2Fe•3H2O↓+CaCl2;故答案为:[CH3CH(OH)COO]2Ca+FeCl2+3H2O$\frac{\underline{\;60-70℃\;}}{\;}$[CH3CH(OH)COO]2Fe•3H2O↓+CaCl2;
(3)根据以上分析,操作1是分离固体与液体混合物中分离出固体的方法,是过滤,操作2是分离乙醇溶液中的乙醇,是蒸馏;操作3是从溶液中分离出晶体的方法,是蒸发浓缩、冷却结晶,
故答案为:过滤;蒸馏;蒸发浓缩、冷却结晶;
(4)根据以上分析,向“滤液a冶中先加H2O2溶液,作用是将亚铁离子氧化为铁离子;然后再调节溶液的 pH 约为5,目的是使铁离子形成氢氧化铁沉淀而除去,
故答案为:将亚铁离子氧化为铁离子;使铁离子形成氢氧化铁沉淀而除去;
(5)根据以上分析,滤液b中含有氢氧化钙和氯化钙,加入稀盐酸时,氢氧化钙与盐酸反应生成氯化钙和水,因此加入稀盐酸的目的是调节溶液至中性或除去多余的氢氧化钙;故答案为:调节溶液至中性或除去多余的氢氧化钙;
(6)样品中n(Cl-)=0.05000mol•L-1×0.02039L×10=0.010195mol,根据n(AgCl)=2n(CaCl2.2H2O),则n(CaCl2.2H2O)=0.0050975mol,所以m(CaCl2.2H2O)=0.0050975mol×147g/mol=0.7493325g,则有:$\frac{0.7493225g}{0.7600g}$×100%=98.60%,
故答案为:98.60%.
点评 本题考查混合物中含量的测定,涉及实验的基本操作、实验仪器的选择、实验误差分析、混合物分离及含量测定的计算等,注意有效数字问题,题目综合性较强,难度中等


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
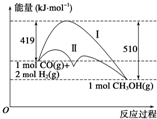 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com