
Na
理由是_______________________________________________________________。
(用离子方程式表示)
在0.1 mol·L-1的Na
A.c(A2-)+c(HA-)+c(H
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+
D.c(Na+)=
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A===H++HA-HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显____(填“酸性”、“中性”或“碱性”),理由是:______(用离子方程式或必要的文字说明)。
(2)常温下,已知0.1 mol·L-1 NaHA溶液pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能_______0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是______。
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_______ ___。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州市高二5月月考化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2A)表示,在水中的电离方程式是:
H2A = H+ + HA-,
HA-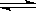 H+ +
A2- 回答下列问题:
H+ +
A2- 回答下列问题:
(1)Na2A溶液呈 (填”酸性,中性或碱性”),理由是,用离子方程式表示:
.
(2)若0.1 mol?L-1NaHA溶液的pH = 2,则0.1 mol?L-1H2A溶液中氢离子的物质的量浓度可能是___________0.11 mol?L-1(填>、<、=)。理由是_________________________
(3)0.1 mol?L-1NaHA溶液中各种离子浓度由大到小的顺序是______________________
查看答案和解析>>
科目:高中化学 来源:2013届天津市高二上学期期末考试化学试卷 题型:填空题
(5分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA;HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是:——。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能
是 0.11 mol·L-1 (填“<”,“>”,或“=”),理由是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com