
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
分析 120℃,0.1mol烃与1molO2(过量)混合,完全燃烧后为CO2、H2O、O2(剩余)混合气体,混合气体通过足量的Na2O2固体,发生反应2CO2+2Na2O2=2Na2CO3+O2,Na2O2增重相当于与CO2等物质的量的CO的质量,发生反应2H2O+2Na2O2=4NaOH+O2,Na2O2增重相当于烃中H元素质量,从Na2O2中溢出的全部气体为16.8L(标况)为氧气,水中的氧元素完全转移到氧气中,反应2CO2+2Na2O2=2Na2CO3+O2导致整个过程中氧气的物质的量减小,根据氧气物质的量减少可以计算CO2的物质的量,再结合过氧化钠质量增重计算H元素的质量,根据原子守恒进而确定化学式,以此解答该题.
解答 解:120℃,0.1mol烃与1molO2(过量)混合,完全燃烧后为CO2、H2O、O2(剩余)混合气体,混合气体通过足量的Na2O2固体,发生反应2CO2+2Na2O2=2Na2CO3+O2,Na2O2增重相当于与CO2等物质的量的CO的质量,发生反应2H2O+2Na2O2=4NaOH+O2,Na2O2增重相当于烃中H元素质量,从Na2O2中溢出的全部气体为16.8L(标况)为氧气,水中的氧元素完全转移到氧气中,反应2CO2+2Na2O2=2Na2CO3+O2导致整个过程中氧气的物质的量减小,
从Na2O2中溢出的全部气体为16.8L(标况)为氧气,其物质的量=$\frac{16.8L}{22.4L/mol}$=0.75mol,故整个过程中氧气物质的量减少1mol-0.75mol=0.25mol,则:
2CO2+2Na2O2=2Na2CO3+O2 氧气物质的量减少
2 1
0.5mol 0.25mol
故烃中氢元素的质量=15g-0.5mol×28g/mol=1g,则氢原子物质的量=$\frac{1g}{1g/mol}$=1mol,
则该烃中C原子数目=$\frac{0.5mol}{0.1mol}$=5、H原子数目=$\frac{1mol}{0.1mol}$=10,
故该烃的分子式为:C5H10,
故选D.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,关键是根据整个过程中氧气的物质的量变化计算二氧化碳,注意理解差量法的应用,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①③⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②③④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.5g | B. | 85g•mol-1 | C. | 65 g | D. | 55g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
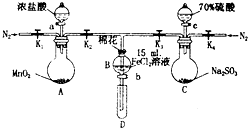 为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com