
| n |
| 2 |
| 3n |
| 2 |
| n |
| 2 |
| 3n |
| 2 |


科目:高中化学 来源: 题型:
| A、金属铝和过量的氢氧化钠溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| C、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
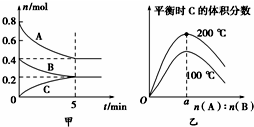 在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol?L-1?min-1 |
| B、200℃时,该反应的平衡常数为25 L2/mol2 |
| C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大 |
| D、由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.| 催化剂 |
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com