
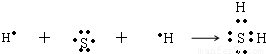 ,
,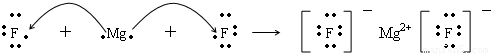
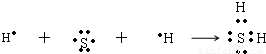 ;
;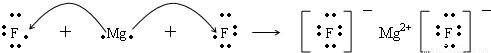 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | 0族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |


| 元素 | 实验设计 | 现象 | 结论 |
| B | 金属性:B > > F(填“>”、“<”或“=”) | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省信阳高中高一下学期期中考试化学试卷(带解析) 题型:填空题
(9分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如下表所示:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市第二中学高一下学期期中考试化学试卷(带解析) 题型:推断题
A、B、C、D、E原子序数依次增大, A、B、E的位置如图所示,A、B两种元素的原子序数之和等于E的核电荷数,E原子核内质子数等于中子数; 1molC的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时C转变为与氖原子具有相同电子层结构的离子;在同一周期的元素形成的简单离子中D最小。请回答:
(1)用电子式表示B和C组成的化合物的形成过程为______________________;
(2)D离子的电子式是 ,A的氢化物的电子式是 ,E原子的化学符号 ;
(3)与E同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)B、E可能形成EB6型化合物,试从化合价角度说明该化合物能否燃烧 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com