
(1)����v(H2O)��ʾ�÷�Ӧǰ20 s��ƽ�����ʣ���v(H2O)=��
(2)��������ƽ�������м�������Na2O���壬���ڴ��¶����ٴδﵽ�µ�ƽ��(�ڶ�ƽ��)����ƽ��ʱH2�����ʵ���________(�������С�����䡱)��������_____________��
(3)����������һƽ��Ļ�������ٳ���a mol H2(a��0.12),����ͬ�����´ﵽ�µ�ƽ��(����ƽ��)����ʱCO�����ʵ���n��ȡֵ��Χ��___________________ ��
������(1)C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
��ʼ 0.2 mol 0 0
20 s�еı仯 0.12 mol 0.12 mol 0.12 mol
����v(H2O)=![]() =0.003 mol��(L��s)-1��
=0.003 mol��(L��s)-1��
(2)Na2O��H2O��Ӧ��ʹˮ����Ũ�Ƚ��ͣ�ƽ�������ƶ�������H2�����ʵ�����С��
(3)����a mol H2����һƽ�⽫���淴Ӧ�����ƶ������Ե�a=0ʱ��n(CO)=0.12��aԽ��n(CO)ԽС��nƽ(CO)=(0.12-a)mol,����0.12-a��n��0.12��
�𰸣�(1)0.003 mol��(L��s)-1
(2)��С Na2O��H2O��Ӧ��ʹˮ������Ũ�Ƚ��ͣ�ƽ�������ƶ� (3)0.12-a��n��0.12



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
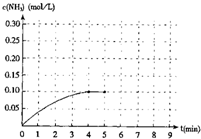 ��һ�ݻ�Ϊ2�����ܱ������ڼ���0.2mol��N2��0.6mol ��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g��+Q��Q��0������Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
��һ�ݻ�Ϊ2�����ܱ������ڼ���0.2mol��N2��0.6mol ��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g��+Q��Q��0������Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011ѧ���㽭ʡ��ʮУ�߶��ڶ�ѧ������������ѧ�Ծ����������� ���ͣ�������
���ݻ�Ϊ2.0 L���ܱ������г���0.60 mol X��1.60 mol Y��������Ӧ��
aX(g)+3Y(g)  2Z(g)
2Z(g)
����10 min��Ӧ�ﵽƽ��״̬��Y��Ũ��Ϊ0.2 mol/L��Z�����ʵ�������Ϊ ��
��
���㣺�� 10min�ڣ�Z��ƽ����Ӧ���ʣ�
�� a ��ֵ��
�� ��������X��ƽ��ת���ʣ��ٷ�����ʾ������һλС������
�ܸ������·�Ӧ2Z(g)  aX(g)+3Y(g)��ƽ�ⳣ����
aX(g)+3Y(g)��ƽ�ⳣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·�����Ӧ��N2(g)��3H2(g)
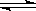 2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ
2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ
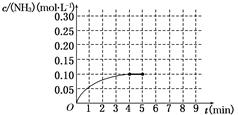
A��0.20 mol��L��1 B��0.12 mol��L��1
C��0.10 mol��L��1 D��0.08 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ̩���и�����һ��ģ�⿼�Ի�ѧ�� ���ͣ�ʵ����
��12�֣���һ�ݻ�Ϊ2 L���ܱ������м���2 molA��3
molB�������¶�Ϊ30�棬�ڴ������ڵ������½������з�Ӧ�� 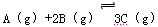 ���ﵽƽ�������1��2 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2��1 mol��
���ﵽƽ�������1��2 mol C����ʱ��ƽ��������C���������Ϊ�أ������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2��1 mol��
��ش��������⣬
��1���÷�Ӧ��ƽ�ⳣ��K���¶����߶� ������������١����䡱�����÷�Ӧ���ʱ��H 0���>������<����=������
��2��30��ʱ��ƽ��������C�����������= ��A���ʵ�ת������B���ʵ�ת����֮��Ϊ ��
��3��30��ʱ������ͬһ�����м���3 molA��4 molB�� molC����ƽ��������C�����������Ϊ�أ���ʱƽ��ʱ��ϵ��A�����ʵ���Ũ��Ϊ mol��L��1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com