
��9�֣��״���һ����Ҫ���л�����ԭ�ϣ���������ȡ���ѡ�һ���¶��£������������Ϊ1.0 L�ĺ����ܱ������з�����Ӧ��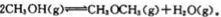
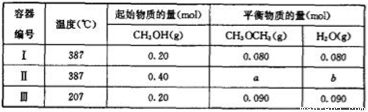
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ��
��2���÷�Ӧ������ӦΪ ������ȡ������ȡ�����Ӧ��
��3���������еķ�Ӧ�ﵽƽ��ʱ�����ʱ�� (����ڡ���С�ڡ����ڡ�) �������е�
��4��a= ��b=
��5����֪����������Ӧ��m��n������0����
��Ӧ�٣�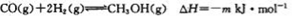
��Ӧ�ڣ�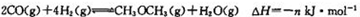
������m��n�Ĺ�ϵ�У���ȷ���� ������ĸ����
A n��2m B m��2n C n=m D m��3n
��1��c(CH3OCH3) ?c(H2O)/c2(CH3OH)
��2������
��3������
��4��0.160��0.160
��5��A
��������
�����������1�����ݻ�ѧ����ʽ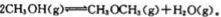 ��֪�÷�Ӧ��ƽ�ⳣ��K= c(CH3OCH3) ?c(H2O)/c2(CH3OH)��
��֪�÷�Ӧ��ƽ�ⳣ��K= c(CH3OCH3) ?c(H2O)/c2(CH3OH)��
��2�����ݷ�ӦI�ͷ�ӦIIIƽ��ʱ��������ʵ��������������¶ȣ���������ʵ������ӣ�˵�������¶�ƽ�������ƶ������������Ƿ��ȷ�Ӧ��
��3����ӦII�еķ�Ӧ��Ũ�ȴ��ڷ�ӦI�еķ�Ӧ��Ũ�ȣ���Ӧ��Ũ������Ӧ���ʼӿ죬����ƽ���ʱ�����̣����Է�ӦII�еķ�Ӧ���ʿ죬��˷�ӦI�еķ�Ӧ�ﵽƽ��ʱ�����ʱ����ڷ�ӦII�еķ�Ӧ�ﵽƽ��ʱ�����ʱ�䣻
��4���÷�Ӧ�Ƿ�Ӧǰ����������ʵ�������Ŀ��淴Ӧ�����Է�ӦII�뷴ӦI�ﵽ��ƽ���ǵ�Чƽ�⣬��ӦII�еķ�Ӧ��Ũ���Ƿ�ӦI�з�Ӧ��Ũ�ȵ�2��������ƽ��ʱ�����Ũ��Ҳ��Ϊԭ����2��������a=b=0.160��
��5�����ݸ�˹���ɵ� ����ЧӦ��H=��-2��=-n-2(-m)=2m-n<0,����n>2m����ѡA��
����ЧӦ��H=��-2��=-n-2(-m)=2m-n<0,����n>2m����ѡA��
���㣺����ƽ�ⳣ���ı����Ӧ��ЧӦ���жϣ���Чƽ����ж���Ӧ�ã���˹���ɵ�Ӧ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�챱���и�����ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�к�����NH4+��Na+��HCO3����CO32����CH3COO�� ���ӣ����м���������Na2O2�������Һ������Ũ�Ȼ������ֲ�����ǣ�������Һ����ޱ仯��
A��Na+ B��CO32����NH4+
C��CH3COO�� D��CH3COO����Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱���ж�������ͨУ����11��������ѧ�Ծ��������棩 ���ͣ������
��8�֣�KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ���������ȣ���仯�ɱ���Ϊ��2KClO3��4HCl(Ũ)=2KCl��2ClO2���� Cl2����2H2O
��1����������________�� ����������________��
��2��Ũ�����ڷ�Ӧ����ʾ������������________(����)
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��3������0��1mol Cl2����ת�Ƶ��ӵ����ʵ���Ϊ________mol��
��4�����������������������ͨ��NaOH�����Եõ�Ư��Һ����Ӧ�����ӷ���ʽΪ___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱��ʮ�и�����һѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��15.2g����ͭ��ɵĺϽ��м��������������Һ���Ͻ���ȫ�ܽ⣬ͬʱ��������X������������Һ�м���������NaOH��Һ������25.4g�����������б�ʾ����X��ɵ�ѡ���к�������
A��0.3 mol NO��0.1 mol NO2
B��0.3 mol NO2��0.1 mol NO
C��0.6 mol NO
D��0.3 mol NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱��ʮ�и�����һѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʳΪ�족����ʱ������չ���º��壬�Ǿ��DZ���ʳƷ��ȫ������ʳ��Ϊ�ȡ�������ʳƷ����ζƷ�����������У�û�з�����ѧ�仯����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���и�����ѧ��9��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�У���Ũ�ȹ�ϵ��ȷ����
A�������£�pH=6�Ĵ������������ɵĻ����Һ�У�c(Na+)>c(CH3COO-)
B����Cl2ͨ�����KOH��Һ�У���ClO-��+c(Cl-)=c(K+)
C��0.1 mol/L��Na2S��Һ�У�c��OH����= c(H��)+ c(HS-)+2 c(H2S)��
D�������£�pH=2��������PH=12�İ�ˮ�������ϣ�������Һ�У�c(Cl-)> c(H��)> c(NH4+)> c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���и�����ѧ��9��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������и�������Һ�У��ܴ����������������
A����ʹpH��ֽ�ʺ�ɫ����Һ�� CH3COOH��NH4+��I-��NO3-
B��������������H2����Һ��K+��Mg2+�� SO42-��HCO3-
C�� c(Fe2+)=0.1mol/L����Һ��H+��Al3+��Cl-��SCN-
D��pH=14����Һ��Na+��NH3��H2O��NO3-��SiO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų���������ظ�����ѧ������ͳһ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����101 kPaʱ��1 mol��������ȫȼ�������ȶ���������ʱ���ų������������������ʵ�ȼ���ȣ���λΪkJ/mol�������й��Ȼ�ѧ����ʽ��������ȷ���� �� ��
A����֪2H2��g����O2��g����2H2O��l����H����571.6 kJ��mol��1����������ȼ����Ϊ285��8 kJ��mol��1
B����֪C��ʯī��s����C�����ʯ��s�� ��H��0������ʯ��ʯī�ȶ�
C����20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ�� NaOH��aq����CH3COOH��aq����CH3COONa��aq����H2O��l����H����57.4 kJ/mol
D����֪2C��s����2O2��g����2CO2��g����H1��2C��s����O2��g����2CO��g�� ��H2�����H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹŸ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
����ͨ�ࣩ(13��)��1�������£� CH3COONa��Һ�� �ԣ������ӷ���ʽ������ԭ�� ��
��2�������£�����0.1 mol��L��1�������20 mL 0.1 mol��L��1��ˮ�У���ҺpH�������������ı仯������ͼ��ʾ��
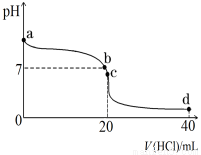
��NH3��H2O�ĵ��뷽��ʽ�� ��
��b����ʾ��Һ�е������� ��
��c����ʾ��Һ�У�����Ũ�ȴӴ�С�Ĺ�ϵΪ ���ڸ���Һ�д��ڶ����غ��ϵ������c(NH4+)+c(H+)= ��������Ũ�ȱ�ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com